Réaction de Kulinkovich-de Meijere
La réaction de Kulinkovich-de Meijere est une réaction de cyclopropanation des amides carboxyliques, conduisant à des aminocyclopropanes.
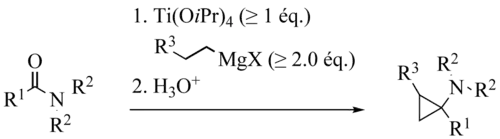
Découverte
La réaction de Kulinkovich-de Meijere fut décrite pour la première fois en 1996 par de Meijere et al[1]. Il s’agit d’une variante de la réaction de Kulinkovich, découverte sept ans plus tôt.
Mécanisme
Tout comme dans le cas de la réaction de Kulinkovich, le mécanisme fait tout d’abord intervenir une insertion 1,2 du groupement carbonyle dans une des deux liaisons carbone-titane du titanacyclopropane 1 initialement formé. Les deux mécanismes divergent après cette étape élémentaire. En effet, dans le cas de la réaction de Kulinkovich-de Meijere, l’oxatitanacyclopentane intermédiaire subit une fragmentation assistée par la paire électronique libre de l’atome d’azote. Le zwitterion ainsi formé subit ensuite la fermeture du cyclopropane par substitution électrophile sur l’atome de carbone portant l’atome de titane.
Échange de ligands
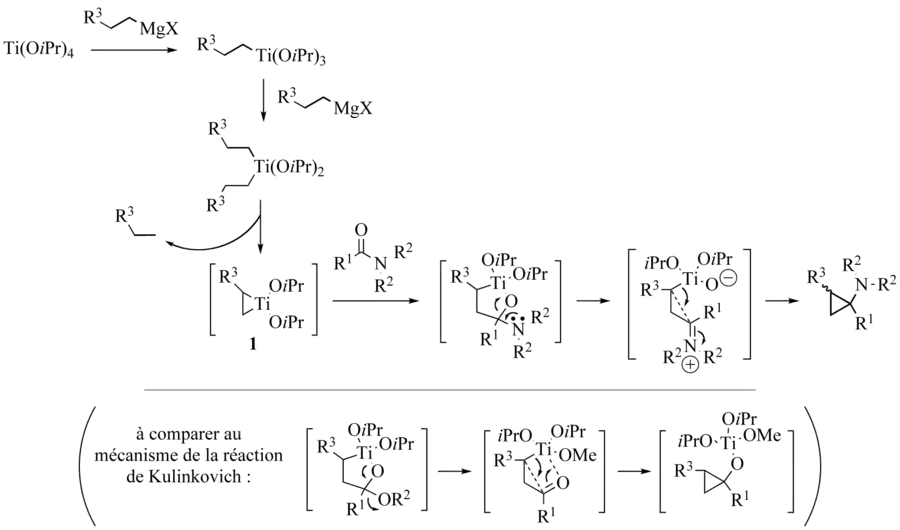
Comme dans le cas de la réaction de Kulinkovich, il est possible, en présence d’une oléfine, d’observer un échange de ligands du titanacyclopropane formé initialement. Cha et al ont ainsi mis au point le couplage inter- et intra-moléculaire des amides avec des oléfines[2]. L’emploi de réactifs de Grignard cycliques est particulièrement adapté à ces réactions d’échange de ligands en déplaçant l’équilibre vers le complexe de titane désiré.
Réactions de Kulinkovich-de Meijere intramoléculaires
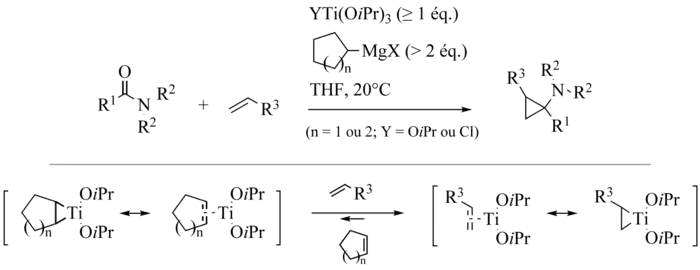
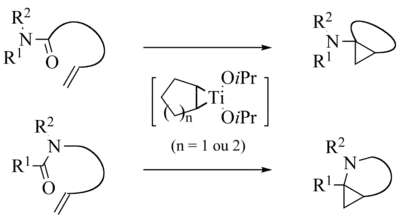
Une application intéressante des réactions d’échange de ligands consiste à réaliser des réactions intramoléculaires au départ d’amides portant une fonction oléfine[2] - [3] - [4] - [5] - [6] - [7] - [8] - [9] - [10] - [11].
Stéréochimie
En général, la diastéréosélectivité de la réaction de Kulinkovich-de Meijere est moins bonne que celle de la réaction de Kulinkovich.
Utilisation du méthyltriisopropyloxytitane
De Meijere et son équipe ont introduit l’emploi de méthyltriisopropyloxytitane comme complexe de titane de départ. Ce réactif présente deux avantages par rapport au tétraisopropyloxytitane habituellement utilisé : un seul équivalent d’organomagnésien permet d’effectuer la réaction, et les rendements en aminocyclopropanes sont en général supérieurs[3].
Réactions apparentées
La réaction de Kulinkovich-de Meijere est apparentée à d’autres transformations :
- la réaction de Kulinkovich, conduisant à des cyclopropanols à partir d'esters carboxyliques.
- la réaction de Kulinkovich-Szymoniak, conduisant à des aminocyclopropanes à partir de nitriles.
Sources d’informations complémentaires
Plusieurs articles récapitulatifs sont parus :
- O. G. Kulinkovich et A. de Meijere, Chem. Rev., 2000, 100, 2789–2834.
- A. de Meijere, S. I. Kozhushkov et A. I. Savchenko in Titanium and Zirconium in Organic Synthesis (Ed.: I. Marek), Wiley-VCH, Weinheim, 2002, pp 390–434.
- A. de Meijere, S. I. Kozhushkov et A. I. Savchenko, J. Organomet. Chem., 2004, 689, 2033–2055.
- A. Wolan et Y. Six, Tetrahedron, 2010, 66, 15–61.
Pour un mode opératoire avec discussion, voir :
Notes et références
- V. Chaplinski, A. de Meijere, Angew. Chem. Int. Ed. Engl., 1996, 35, 413-414.
- J. Lee, J. K. Cha, J. Org. Chem., 1997, 62, 1584-1585.
- V. Chaplinski, H. Winsel, M. Kordes, A. de Meijere, Synlett, 1997, 111-114.
- B. Cao, D. Xiao, M. M. Joullié, Org. Lett., 1999, 1, 1799-1801.
- H. B. Lee, M. J. Sung, S. C. Blackstock, J. K. Cha, J. Am. Chem. Soc., 2001, 123, 11322-11324.
- M. Gensini, S. I. Kozhushkov, D. S. Yufit, J. A. K. Howard, M. Es-Sayed, A. de Meijere, Eur. J. Org. Chem., 2002, 2499-2507.
- G.-D. Tebben, K. Rauch, C. Stratmann, C. M. Williams, A. de Meijere, Org. Lett., 2003, 5, 483-485.
- N. Ouhamou, Y. Six, Org. Biomol. Chem., 2003, 1, 3007-3009.
- M. Gensini, A. de Meijere, Chem. Eur. J., 2004, 10, 785-790.
- L. Larquetoux, J. A. Kowalska, Y. Six, Eur. J. Org. Chem., 2004, 3517-3525.
- L. Larquetoux, N. Ouhamou, A. Chiaroni, Y. Six, Eur. J. Org. Chem., 2005, 4654-4662.