Nabiximols
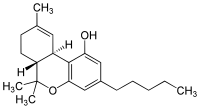
Le nabiximols (nom choisi aux États-Unis[1], nom commercial : Sativex) est un médicament sous forme de spray buccal développé dans le traitement de la sclérose en plaques afin de diminuer les douleurs neuropathiques, la spasticité, une vessie hyperactive, et d'autres symptômes[2]. Les composés actifs de ce produit sont le tetrahydrocannabinol (THC) et le cannabidiol (CBD), composés produits par la plante Cannabis sativa. Le nabiximols est différent des autres cannabinoïdes utilisés en médecine car il est constitué d'un mélange de composés extraits directement de la plante de cannabis et non pas d'une seule molécule synthétique.
| Sativex | ||
| ||
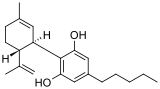 | ||
| Tétrahydrocannabinol (en haut) et cannabidiol (en bas) | ||
| Identification | ||
|---|---|---|
| Synonymes |
mélange de tétrahydrocannabinol et de cannabidiol |
|
| No CAS | ||
| Code ATC | ||
| PubChem | 44148067 | |
| Unités du SI et CNTP, sauf indication contraire. | ||
Prescription
Il est utilisé pour diminuer la spasticité dans la sclérose en plaques[3] - [4].
Effets indésirables
Le nabiximols est généralement bien toléré[5] - [6] - [7].
Les effets indésirables les plus fréquents sont une sensation de vertige, une somnolence, une désorientation. Il n'y a pas de données disponible sur le développement d'une potentielle dépendance au nabiximols[3].
Disponibilité
France
Une autorisation provisoire de mise sur le marché de six mois a été accordée par l'ANSM[8]. Dans un premier temps, seuls les neurologues et les médecins rééducateurs hospitaliers seront autorisés à le prescrire. Les pharmacies devront le stocker sous coffre, comme la législation l'impose pour les produits de santé dérivés de stupéfiants. Néanmoins, en 2018, le médicament n'a toujours pas été commercialisé en France, faute d'accord sur son prix[9].
Portugal
Au Portugal, il est autorisé depuis 2012 pour son indication à la sclérose en plaques. Entre 2017 et 2018, le groupement des six hôpitaux de Lisbonne en a délivré 21 doses[10] au prix de 500 euros non remboursés.
Notes et références
- (en) United States Adopted Names Coincil: Statement on a nonproprietary name
- (en) « Improving Patients' Lives - Jazz Pharmaceuticals », sur Jazz Pharmaceuticals (consulté le ).
- (de) Schubert-Zsilavecz, M, Wurglics, M. Neue Arzneimittel 2011/2012
- (en) Shaheen E Lakhan et Marie Rowland, « Whole plant cannabis extracts in the treatment of spasticity in multiple sclerosis: a systematic review », BMC Neurol, vol. 9, , p. 59 (PMID 19961570, PMCID 2793241, DOI 10.1186/1471-2377-9-59)
- (en) Wade D, Makela P, Robson P, House H, Bateman C, « Do cannabis-based medicinal extracts have general or specific effects on symptoms in multiple sclerosis? A double-blind, randomized, placebo-controlled study on 160 patients », Mult Scler, vol. 10, no 4, , p. 434–41 (PMID 15327042, DOI 10.1191/1352458504ms1082oa)
- (en) Wade D, Makela P, House H, Bateman C, Robson P, « Long-term use of a cannabis-based medicine in the treatment of spasticity and other symptoms in multiple sclerosis », Mult Scler, vol. 12, no 5, , p. 639–45 (PMID 17086911, DOI 10.1177/1352458505070618)
- (en) Wade D, Robson P, House H, Makela P, Aram J, « A preliminary controlled study to determine whether whole-plant cannabis extracts can improve intractable neurogenic symptoms », Clin Rehabil, vol. 17, no 1, , p. 21–9 (PMID 12617376, DOI 10.1191/0269215503cr581oa)
- Laetitia Clavreul et Chloé Hecketsweiler, « Le Sativex, médicament à base de cannabis, autorisé en France », Le Monde, (lire en ligne)
- « Cannabis thérapeutique : pourquoi le Sativex n'est-il toujours pas vendu en France ? »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?); Sativex: quatre ans de bras de fer, mediapart, 23 janvier 2018
- (pt) Em dois anos, medicamento à base de cannabis só foi prescrito 21 vezes, publico.pt, 25 février 2018