Maghémite
La maghémite est une espèce minérale, formée d'oxyde de fer de formule Fe2O3. Elle se forme par météorisation de minéraux contenant du fer ou par thermolyse de la lépidocrocite : γ-FeO(OH). La thermolyse de la lépidocrocite ne donne en effet jamais directement naissance à l’hématite α-Fe2O3, qui est pourtant le composé le plus stable et qui constitue la phase terminale de l’oxydation du fer. Un composé intermédiaire se forme, appelé maghémite (contraction de "magnétite" et de "hématite"), de formule γ-Fe2O3. Il possède en effet une structure cristalline similaire à celle de la magnétite de formule Fe3O4 mais en revanche, il présente la même formule chimique que l'hématite, Fe2O3. La maghémite peut également être obtenue par oxydation de la magnétite, en particulier pour la synthèse des ferrofluides.

Structure cristalline
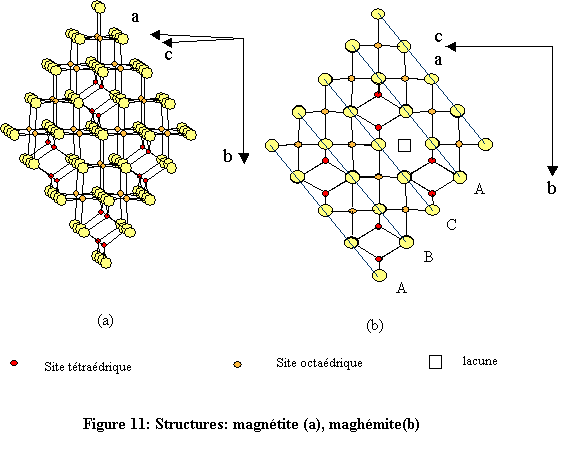
La magnétite est un oxyde mixte de fer(II) et de fer(III) de structure spinelle (aluminate de magnésium : Mg(II)Al(III)2O4) ; le cation divalent Mg(II) se trouvant en sites tétraédriques et le cation trivalent Al(III) en sites octaédriques. Dans le cas de la magnétite Fe(III)[Fe(III)Fe(II)O4], le spinelle est inverse car les sites tétraédriques sont occupés par un cation trivalent. Pour ce qui concerne la maghémite, le fer se trouve entièrement dans l’état trivalent d’oxydation,Fe(III), ce qui se traduit par l’apparition de lacunes cationiques, notées □.
La formule de la maghémite en relation avec celle de la magnétite peut s’écrire :
- Fe(III)tétra[(Fe(III)5/3 □1/3)octaO4 ; ce qui est équivalent à la formule Fe2O3.
La maghémite peut donc être considérée comme une magnétite oxydée. Les structures de la magnétite et de la maghémite présentent évidemment une grande similitude même si leur groupes spatiaux sont différents.
La magnétite cristallise dans le système cubique, groupe d'espace Fd-3m (n° 227),
- a = 8,396 Å.
La présence de lacunes cationiques ordonnées dans la maghémite se traduit par la cristallisation dans le système quadratique de groupe P41212 (n° 92) et de paramètres
- a = 8,35 Å,
- c = 3•a = 25,05 Å.
Les deux structures sont construites à l’aide d’octaèdres FeO6 et de tétraèdres FeO4.
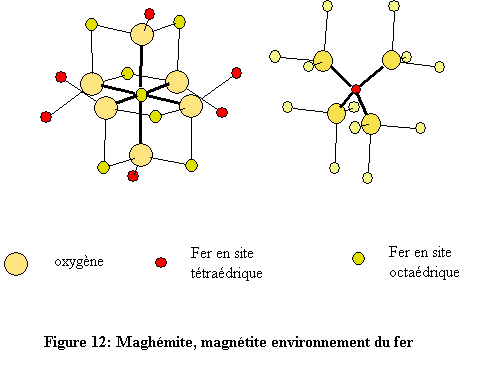
Chaque octaèdre est relié à six autres octaèdres par six côtés et à six différents tétraèdres par six sommets. Quant à l’environnement tétraédrique du fer, chaque tétraèdre est relié à douze octaèdres par ses quatre sommets (fig. 12). L’environnement de l’oxygène est constitué de quatre atomes de fer, trois en sites octaédriques et un en site tétraédrique. Les atomes d’oxygène définissent des couches à empilement compact de type cubique à faces centrées (cfc : ABC)[1].
Propriétés magnétiques
Présente avec la magnétite dans des dendrites nerveuses du bec des pigeons, la maghémite serait liée à leur faculté d'orientation[2].
Références
- Y. Cudennec, A. Lecerf, Solid State Sciences, 7 (2005), pp.520-529 [(en) lire en ligne].
- Résumé en français de l'article original