Loi d'Amagat
En chimie physique, et plus particulièrement en thermodynamique, la loi d'Amagat, ou loi des volumes partiels, loi d'additivité des volumes, établie expérimentalement par Émile Amagat, énonce que :
« Le volume total d'un mélange gazeux est la somme des volumes partiels des gaz constituants. »
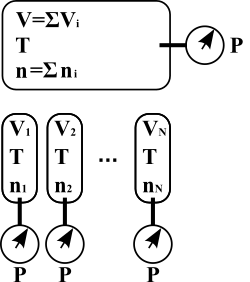
— Loi d'Amagat
La loi d'Amagat est le pendant pour les volumes de la loi de Dalton concernant les pressions. Elle n'est valable que pour les gaz parfaits et n'est applicable approximativement aux gaz réels qu'aux basses pressions.
Énoncé mathématique
Si l'on considère volumes de gaz différents, tous à la pression et à la température , alors le mélange de ces gaz produit un volume total à la pression et à la température tel que :
avec le volume du gaz seul à la pression et à la température .
Limites de la loi
Dans le cas des gaz réels, les forces de van der Waals, interactions à distance entre les molécules, induisent une contraction du volume si les molécules des diverses espèces s'attirent, ou une dilatation du volume si elles se repoussent. Selon le cas cela induit un volume plus petit ou plus grand que celui prévu par la loi d'Amagat.
Cette loi n'est vraie qu'aux basses pressions, lorsque les interactions entre molécules sont négligeables et que les gaz réels se comportent comme des gaz parfaits. Dans ces conditions, le volume de chaque gaz à la pression et à la température vaut :
avec la quantité du gaz et la constante universelle des gaz parfaits. Le volume total du mélange vaut alors, en application de la loi des gaz parfaits :
Application : les fractions volumiques
Le volume étant une grandeur extensive, il est directement proportionnel à la quantité de matière qu'il contient. Ainsi, pour chacun des gaz du mélange considéré seul on peut écrire :
avec le volume molaire du gaz pur à la pression et à la température . La loi d'Amagat donne par conséquent :
Or selon loi d'Avogadro aux mêmes pression et température tous les gaz parfaits ont le même volume molaire :
On peut donc écrire, en prenant n'importe quel gaz du mélange comme référence :
Le ratio du volume du corps pur au volume du mélange aux mêmes pression et température est appelé fraction volumique. Dans le cas d'un mélange de gaz parfaits la fraction volumique d'un corps est égale à sa fraction molaire. On vérifie par la loi d'Amagat que :
Dans le cas des gaz réels, la loi d'Amagat n'étant pas vérifiée :
Dans le cas des gaz réels les fractions volumiques ne peuvent être identifiées aux fractions molaires.
Voir aussi
Bibliographie
- Lucien Borel et Daniel Favrat, Thermodynamique et énergétique, vol. 1, PPUR presses polytechniques, , 814 p. (ISBN 9782880745455, lire en ligne), p. 300.
- Henry Fauduet, Principes fondamentaux du génie des procédés et de la technologie chimique, Lavoisier, , 800 p. (ISBN 9782743064556, lire en ligne), p. 149-150.
- (en) Shiv Kumar, Thermal Engineering, vol. 1, Springer Nature, , 579 p. (ISBN 9783030672744, lire en ligne), p. 29-30.
- Michel Lagière, Physique industrielle des fluides : notions fondamentales et applications numériques, Éditions TECHNIP, , 394 p. (ISBN 9782710807018, lire en ligne), p. 125.
Liens externes
- UQAC - Université du Québec à Chicoutimi, « CHIMIE PHYSIQUE - CHAPITRE 2 - Le gaz idéal » (consulté le ).






















