Iodite
Un iodite est un sel de l'acide iodeux HIO2. L'ion iodite est l'anion IO2−. Dans ces sels comme dans l'ion, l'iode est à l'état d'oxydation +III.
| Iodite | ||
| ||
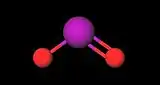 | ||
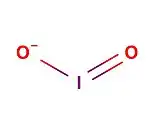
| Formule topologique (fig.1) et représentation 3D avec boules à 20% de la molécule d'iodite | ||
| Identification | ||
|---|---|---|
| Nom UICPA | iodite | |
| Nom systématique | dioxidoiodate(1−) | |
| No CAS | ||
| PubChem | 5460637 | |
| SMILES | ||
| InChI | ||
| Propriétés chimiques | ||
| Formule | IO2− | |
| Masse molaire | 58.90327 | |
| Composés apparentés | ||
| Autres anions | Chlorite | |
| Unités du SI et CNTP, sauf indication contraire. | ||
Acide et sels
L'acide iodeux et les iodites, très instables, ont été observés[1] mais jamais isolés[2]. Ils se dissocient rapidement en molécules d'iode et d'iodate[1]. Ils ont aussi été détectés comme intermédiaires dans la conversion d'un iodure en iodate[3] - [4].
Autres états d'oxydation
L'iode peut prendre les nombres d'oxydation −I, +I, +III, +V ou +VII. On connaît également un certain nombre d'oxydes d'iode neutres.
| Nombre d'oxydation de l'iode | −I | +I | +III | +V | +VII |
|---|---|---|---|---|---|
| Nom des sels ou de l'ion | Iodure | Hypoiodite | Iodite | Iodate | Periodate |
| Formule de l'ion | I− | IO− | IO2− | IO3− | IO4− ou IO65− |
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Iodite » (voir la liste des auteurs).
- (en) Norman N. Greenwood, Alan Earnshaw, Chemistry of the Elements, Butterworth-Heinemann, (ISBN 978-0-08-037941-8)
- R. C. Ropp, Encyclopedia of the alkaline earth compounds, Elsevier, (ISBN 978-0-444-59553-9 et 0-444-59553-8, OCLC 827243061, lire en ligne), p.93
- (en) Yugul Kishore Gupta et Devendra Nath Sharma, « Kinetics and mechanism of the reduction of iodate to iodite by bromide in the presence of phenol », The Journal of Physical Chemistry, vol. 75, no 16, 1971-08-xx, p. 2516–2522 (ISSN 0022-3654 et 1541-5740, DOI 10.1021/j100685a018, lire en ligne, consulté le )
- (en) Mary K. Gilles, Mark L. Polak et W. C. Lineberger, « Photoelectron spectroscopy of the halogen oxide anions FO − , ClO − , BrO − , IO − , OClO − , and OIO − », The Journal of Chemical Physics, vol. 96, no 11, 1992-06-xx, p. 8012–8020 (ISSN 0021-9606 et 1089-7690, DOI 10.1063/1.462352, lire en ligne, consulté le )
Cet article est issu de wikipedia. Text licence: CC BY-SA 4.0, Des conditions supplémentaires peuvent s’appliquer aux fichiers multimédias.