Dilution
La dilution est un procédé consistant à obtenir une solution de concentration inférieure à celle de départ, soit par ajout de solvant, soit par prélèvement d'une partie de la solution et en complétant avec du solvant pour garder le même volume. La dilution se caractérise par son taux de dilution, appelé aussi facteur de dilution. Cette notion présuppose que le corps dilué soit soluble dans le solvant utilisé.

Dilution par ajout de solvant
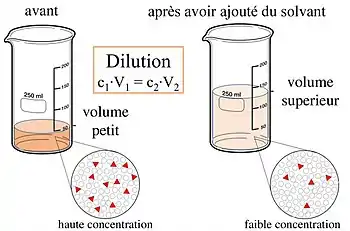
La concentration d'une solution est notée , avec mesure (de masse ou de quantité de matière) du soluté en solution dans le volume de solvant. Selon que est exprimée en unité de masse, ou de quantité de matière, est respectivement une concentration massique ou molaire.
Si on effectue une dilution par ajout de solvant :
- la solution initiale (appelée solution mère) et la solution finale (appelée solution fille) contiennent autant de quantité de soluté : ;
- la solution initiale a pour volume , la solution finale ;
- la concentration initiale est , la concentration finale ;
- on a les relations :
- or
- donc le rapport entre les deux concentrations est le suivant :
Dilution par prélèvement
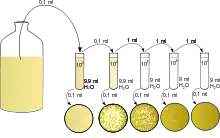
Lors d'une dilution par prélèvement, le volume final de la solution fille contient autant de quantité de matière de soluté que celui contenu dans le volume de solution mère prélevé.
Taux de dilution
Le taux de dilution (ou facteur de dilution ) peut être exprimé par : .
est un nombre obligatoirement inférieur à 1 et positif, sans unité.
Le taux de dilutions successives est le produit des taux de dilution de chaque dilution. Par exemple, si on fait une dilution à 3 % puis à 5 %, on a :
- .
Taux de dilution en homéopathie
Il existe des dilutions en homéopathie à partir de matériaux non solubles et de matériaux solubles.
Articles connexes
Notes et références
- Anne-Sophie Bernard, Sylvain Clède, Matthieu Emond, Hélène Monin-Soyer, Jérôme Quérard, Techniques expérimentales en chimie, Dunod, , p. 31-32.














