Désorption-ionisation par électronébulisation
La désorption-ionisation par électronébulisation (Desorption electrospray ionization, DESI) est une méthode d’ionisation communément utilisée en spectrométrie de masse.
Présentation
Cette méthode permet l’ionisation d’une grande variété de composés, incluant les peptides et les protéines présents dans les métaux, les polymères et la surface des minéraux[1]. La DESI a même permis l’imagerie de tissus intacts de cerveau de rat sous des conditions ambiantes[2].
Principe de la méthode
Tout d’abord, la DESI est une méthode instrumentale regroupant les aspects de l’ESI (Electrospray Ionization) et de la famille des méthodes DI (Desorption Ionization). Ainsi, la DESI ressemble aux expériences d’ESI et la relation entre DI et DESI et également proche l’une de l’autre[3].
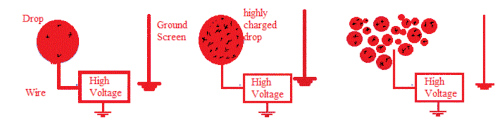
De plus, les méthodes DI plus traditionnelles, telles que plasma desorption, PD ; laser desorption ionization, LDI ; matrix assisted laser desorption ionization, MALDI ; secondary ion mass spectrometry, SIMS ; fast atom bombardment, FAB, sont effectuées dans un vide poussé, car les projectiles ne peuvent qu’avoir une énergie cinétique faible. Toutefois, la DESI se distingue de ces méthodes principalement parce qu’elle est effectuée à pression atmosphérique grâce à l’énergie cinétique élevée des particules[3].
Le principe de cette méthode analytique est de générer un spray de très fine gouttelettes électriquement chargées. De manière analogue à la façon dont la DESI fonctionne, un aérosol utilise un gaz comprimé pour générer les gouttelettes et les expulser du contenant. La DESI utilise l’électricité à la place d’un gaz comprimé. Le liquide est chargé dans « l’embout » en appliquant une très haute différence de potentiel. De cette manière, le liquide contenu devient instable dû à la répulsion électrostatique jusqu’au point où les charges électriques ne peuvent plus être contenues. Une fois ce point critique atteint, le liquide « explose » en de très fines gouttelettes hautement chargées. Ces gouttelettes bombardent, à travers l’atmosphère, à haute vélocité, la surface de l’échantillon analysé.
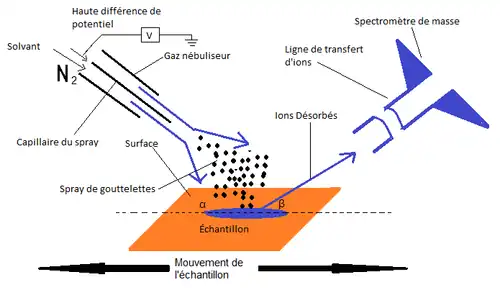
Ainsi, l’impact du spray cause la formation de couches microscopiques de liquide à la surface, dans lesquelles la phase condensée de l’analyte se dissout. Par la suite, ce processus est suivi par la désorption via un transfert de momentum lorsque d’additionnelles gouttelettes percutent les fines couches de liquide précédemment formées. Ceci force donc l’analyte dissout dans ces couches liquides à tomber en phase gazeuse sous forme de microgouttelettes[4].
De plus, cette technique permet l’analyse de molécules organiques en surface de l’échantillon, par MS, sans avoir besoin de traiter l’échantillon dans le but de le préparer à l’analyse. En effet, l’ionisation est effectuée en envoyant un spray de fine gouttelettes d’eau électriquement chargée directement sur l’échantillon à l’aide d’un électrospray pneumatiquement assisté. Les ions générés sont ensuite transportés par l’air, à pression atmosphérique, jusqu’à l’atteinte de l’interface du spectromètre de masse[3].
La DESI a été un énorme avancement dans la spectrométrie de masse. En effet, ce principe d’ionisation peut être couplé à une panoplie de méthodes telles que MALDI pour donner un MALDESI. Ceci fonctionne très bien avec un FT-ICR MS (Fourier transform – ion cyclotron resonance mass spectrometer). Le fait de pouvoir analyser des échantillons sous des conditions ambiantes avec peu, voire aucun, prétraitement de l’échantillon a permis le développement de méthodes d’ionisation dans différents domaines : environnement, criminalistique, biomédicale et science des matériaux[5].
Application de la méthode
Dans un autre ordre d’idée, un DESI couplé à un spectromètre de masse à trappe ionique et utilisée pour enregistrer l’intensité spatiale de la distribution d’une drogue provenant directement de section de cerveau, poumon, rein et testicule sans traitement chimique préalable. L’imagerie par DESI a donné l’identification et la distribution de la clozapine après une dose orale de 50 mg/kg. Le tout a été fait en mesurant l’abondance d’ions intacts pour un rapport masse sur charge (m/z) de 327,1 et en surveillant la dissociation du composée médicamenteux protoné à m/z 327,1 à son ion dominant à m/z 270,1. L’imagerie DESI a été effectuée en mode scan-complet avec un intervalle de m/z variant de 200 à 1 100, donnant ainsi l’opportunité d’une quantification relative en utilisant un lipide endogène pour normaliser le signal de la clozapine. L’étude a révélé la présence de clozapine dans tous les types de tissus analysés. Aussi, la présence de métabolite N-desméthyl a été détectée dans les tissus pulmonaires seulement. La quantification de la clozapine dans les tissus en utilisant LC-MS/MS a révélé des concentrations variant de 0,05 µg/g (cerveau) à des concentrations aussi élevées que 10,6 µg/g (poumon). Ces résultats concordent avec ceux obtenus par DESI[6].
En outre, les images moléculaires sont construites en traçant le graphe de l’intensité du signal de un ou plusieurs ions dérivés de la surface en fonction de la position. Puisqu’un spray DESI est un flux continus de gouttelettes chargés, la surface est analysée de façon unidirectionnelle à vélocité constante. Dans le cadre de cette expérience, la surface bouge de droite à gauche en direction orthogonale de l’entrée du spectromètre de masse avec le spray dirigé vers cette entrée. Le motif de balayage est tel qu’elle descend l’échantillon de tissus afin de ne pas examiner les parties qui pourraient avoir été contaminés lorsque la rangée précédente a été analysée[6].
Conclusion
La DESI est une méthode analytique qui offre beaucoup de potentiel en analyse spectrométrique de masse, dans une variété de domaine. En effet, elle peut être utilisée dans le domaine pharmaceutique, tel que vu par l’expérience brièvement présentée, biologique, ou encore environnemental et a révolutionné le monde de la spectrométrie de masse. De plus, il est possible de combiner cette méthode d’ionisation à une panoplie de méthodes analytiques telles que la QTOF MS (quadrupole time-of-flight mass spectrometry)[7], ou encore à un MALDI pour former un MALDESI. Une vaste variété de possibilités s’offre à la chimie analytique avec la DESI.
Références
- Zoltán Takáts, Justin M. Wiseman, Bogdan Gologan, R. Graham Cooks, Mass Spectrometry Sampling Under Ambient Conditions with Desorption Electrospray Ionization, Science Mag AAAS, vol. 306, n° 5695, p. 471-473 (consulté le 29 novembre 2015).
- Wiseman, J. M., Ifa, D. R., Song, Q. et Cooks, R. G. (2006), Tissue Imaging at Atmospheric Pressure Using Desorption Electrospray Ionization (DESI) Mass Spectrometry, Angewandte Chemie International Edition, 45 : 7188–7192, DOI 10.1002/anie.200602449 (consulté le 29 novembre 2015).
- Takáts, Z., Wiseman, J.M. et Cooks, R.G. (2005), Ambient mass spectrometry using desorption electrospray ionization (DESI): instrumentation, mechanisms and applications in forensics, chemistry, and biology, J. Mass Spectrom., 40 : 1261–1275, DOI 10.1002/jms.922 (consulté le 29 novembre 2015).
- Desportion Electrospray Ionization Technology Description, sur prosolia.com (consulté le 29 novembre 2015)
- Jason S. Sampson, Adam M. Hawkridge, David C. Muddiman, Generation and Detection of Multiply-Charged Peptides and Proteins by Matrix-Assisted Laser Desorption Electrospray Ionization (MALDESI) Fourier Transform Ion Cyclotron Resonance Mass Spectrometry, Journal of the American Society for Mass Spectrometry, Science Direct, vol. 17, n° 12, décembre 2006, p. 1712 – 1716 (consulté le 29 novembre 2015).
- Justin M. Wisemana, Demian R. Ifa, Yongxin Zhu, Candice B. Kissinger, Nicholas E. Manicke, Peter T. Kissinger, R. Graham Cooks, Desorption electrospray ionization mass spectrometry : Imaging drugs and metabolites in tissues, PNAS (consulté le 1er décembre 2015).
- Daniel J. Weston, Robert Bateman, Ian D. Wilson, Tim R. Wood, Colin S. Creaser, Direct analysis of Pharmaceutical Drug Formulations Using Ion Mobility Spectrometry/Quadrupole-Time-of-Flight Mass Spectrometry Combined with Desorption Electrospray Ionization, Anal. Chem. (consulté le 1er décembre 2015).