Déposition (physique)
En physique, la déposition, appelée aussi dépôt, désublimation, sublimation inverse, sublimation régressive ou condensation solide, est le changement d'état d'un corps de l'état gazeux à l'état solide (sans passer par l'état liquide). Le processus thermodynamique inverse se nomme sublimation[1].

Applications
Applications industrielles

Les techniques de dépôt sous vide (dépôt chimique en phase vapeur, dépôt physique par phase vapeur) font appel à plusieurs méthodes (évaporation sous vide, bombardement ionique, arc électrique, laser, réactions chimiques entre plusieurs vapeurs) pour déposer par sublimation inverse des vapeurs sur des surfaces qu'on veut pourvoir d'un revêtement spécifique (par exemple la fabrication des CD et DVD comprend une étape de métallisation (en) qui consiste à déposer une couche d'aluminium réfléchissante dans une cabine sous vide). La formation de gelée blanche et le dépôt dans la cheminée des composantes gazeuses de la suie sont analogues à ces dépôts physiques et chimiques utilisés dans l'industrie[2].
Des composés d'intérêt tels que l'iode peuvent être purifiés ou extraits de mélanges hétérogènes par ce procédé de transition de phase qui consiste à faire baisser la température des vapeurs à une pression fixe en dessous de celle du point triple, ce qui les fait passer directement à l'état solide[3].
Physique des nuages
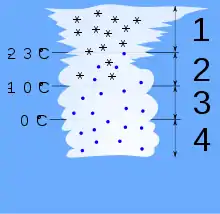
La formation des nuages implique la condensation de gouttelettes d'eau, puis la solidification et la condensation solide de cristaux de glace[4]. Le grossissement des gouttelettes et des cristaux s'explique par l'effet de coalescence et l'effet Bergeron[5]. Ces processus se retrouvent dans le diagramme à gauche :
- Cristaux de glace ;
- Neige et gouttelettes surfondues (dominé par l'effet Bergeron) ;
- Gouttelettes surfondues (dominé par la coalescence) ;
- Gouttelettes de pluie.
Galerie
 Diagramme des principaux changements d'état de la matière.
Diagramme des principaux changements d'état de la matière.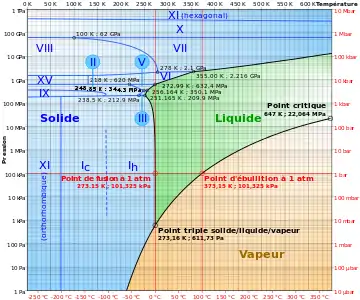 Diagramme de phase de l'eau.
Diagramme de phase de l'eau..jpg.webp) Parhélie engendrée par la réflexion et réfraction des cristaux de poudrin de glace formés par sublimation régressive.
Parhélie engendrée par la réflexion et réfraction des cristaux de poudrin de glace formés par sublimation régressive.
Notes et références
- Robert Delmas, Serge Chauzy, Jean-Marc Verstraete, Atmosphère, océan et climat, Belin, , p. 63.
- Hans Jörg Mathieu, Erich Bergmann, René Gras, Analyse et technologie des surfaces: couches minces et tribologie, PPUR, , p. 238.
- (en) Ralph H. Petrucci, General Chemistry: Principles and Modern Applications, Macmillan, , p. 404.
- Robert Delmas, Serge Chauzy, Jean-Marc Verstraete, Atmosphère, océan et climat, Belin, , p. 83.
- Joël Van Baelen, « Pluie, neige, grêle... entre le ciel et la terre », Pour la science, no 78, , p. 71.
- (en) B.A. Smith, « Wollaston's cryophosphorus-precursor of the heat pipe », Physics Education, vol. 15, no 5, , p. 310–314 (DOI 10.1088/0031-9120/15/5/006).
Voir aussi
Bibliographie
- (en) John W. Moore, Conrad L. Stanitski, Chemistry: The Molecular Science, Cengage Learning, , p. 386-391