ARNsn U6
L’ARNsn U6 est un petit ARN nucléaire (small nuclear RNA ou snRNA, en anglais) entrant dans la composition des petites ribonucléoprotéines nucléaires U6. Il se combine avec d'autres snRNP, de l'ARN pré-messager non modifié et diverses autres protéines pour former un splicéosome, complexe moléculaire ribonucléoprotéique important qui permet à l'épissage des ARN pré-messagers de se produire. L'épissage, ou la suppression des introns, est une étape majeure de la maturation post-transcriptionnelle des ARN et a lieu principalement dans le noyau chez les eucaryotes.
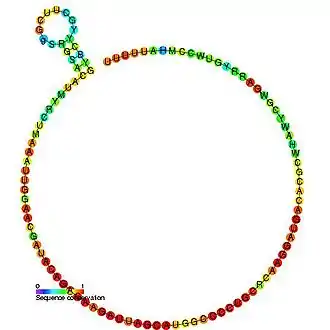
Des cinq ARNsn impliqués dans le splicéosome[1], la séquence de l'ARNsn U6 est la plus hautement conservée à travers les espèces, suggérant que sa fonction est restée à la fois cruciale et inchangée au cours de l'Évolution.
On trouve fréquemment dans le génome des vertébrés de nombreuses copies du gène U6 ou des pseudogènes dérivés[2]. Cette prévalence de « back-up » montre en outre son importance au cours de l'évolution pour la viabilité de l'organisme.
Le gène codant U6 a été isolé chez de nombreux organismes, comme C. elegans[3]. C'est la levure de boulanger (Saccharomyces cerevisiae) qui est couramment utilisée comme organisme modèle dans l'étude des ARNsn.
Rôle
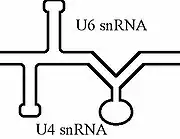
Les séquences de bases de l'ARNsn U6 lui permettent de se lier étroitement à l'ARNsn U4 et vaguement à l'ARNsn U5 pour former un trimère pendant la phase initiale de la réaction d'épissage. Lorsque la réaction progresse, l'ARNsn U6 se détache progressivement de U4 et se lie à l'ARNsn U2. À chaque étape de cette réaction, la structure secondaire de U6 subit d'importantes modifications conformationnelles[4].
L'association de U6 à l'extrémité 5' de l'intron par appariement de bases au cours de la réaction d'épissage se produit avant la formation intermédiaire du lasso et est nécessaire pour que le processus d'épissage puisse avoir lieu. L'association de U6 avec U2 par appariement de bases constitue le complexe U2-U6, une structure qui comprend le site actif du splicéosome[5].
Structure secondaire
Bien qu'il y ait un consensus sur la structure secondaire supposée limité à un court segment de la structure tige-boucle 5', on a proposé des modèles de structures beaucoup plus vastes pour des organismes spécifiques comme la levure[6]. En plus de la boucle 5', tous les U6 peuvent former une tige par association intramoléculaire avec la boucle 3'[7]
L'ARNsn U6 est connu pour former un long appariement de bases avec U4[8] - [9]. On a montré que cette interaction excluait la possibilité d'appariement interne avec la boucle 3'[10].
Protéines associées
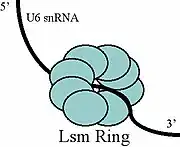
L'ARNsn U6 lorsqu'il est libre peut s'associer aux protéines Prp24 et LSms[11]. On pense que la protéine Prp24 forme un complexe intermédiaire avec l'ARNsn U6 facilitant l'important appariement entre U4 et U6[12] - [13]et les LSms pourraient aider la protéine Prp24 à s'apparier. L'emplacement approximatif des domaines de liaison de ces protéines a été déterminé[14] et ces dernières ont ensuite été visualisées au microscope électronique[15]. Cette étude suggère que la protéine Prp24 se lie à l'extrémité 3' de la forme libre de U6 dans sa région riche en uridine en passant à travers un anneau de LSms.
Notes et références
- (en) D. Brow, C. Guthrie, « Spliceosomal RNA U6 is remarkably conserved from yeast to mammals », Nature, vol. 334, , p. 213-218
- (en) M. Marz, T. Kirsten, P. Stadler, « Evolution of spliceosomal snRNA genes in metazoan animals », J. Mol. Evol.,
- (en) J. Thomas, K. Lea, E. Zucker-Aprison, T. Blumenthal, « The spliceosomal snRNAs of Caenorhabditis elegans », Nucleic Acids Res, vol. 18, , p. 2633-2642 (PMID 2339054, DOI 10.1093/nar/18.9.2633)
- (en) D Fortner, Troy G et Brow D, « A stem loop in U6 RNA defines a conformational switch required for pre-mRNA splicing », Genes & Development, vol. 8, , p. 221-233
- (en) Robert F. Weaver (2005). Molecular Biology, p.433-437. McGraw-Hill, New York, NY. (ISBN 978-0-07-284611-9).
- (en) R. Karadumman, P. Fabrizio, K. Hartmuth, H. Urlaub, R. Luhrmann, « RNA Structure and RNA–Protein Interactions in Purified Yeast U6 snRNPs », J. Mol. Biol.,
- (en) S. Butcher, D. Brow, « Towards understanding the catalytic core structure of the spliceosome », RNA Structure and Function, vol. 33, , p. 448-449
- (en) D. Brow, C. Guthrie, « Spliceosomal RNA U6 is remarkably conserved from yeast to mammals », Nature, vol. 334, , p. 213-218
- (en) H. Orum, H. Nielsen, J. Engberg, « Spliceosomal small nuclear RNAs of Tetrahymena thermophila and some possible snRNA-snRNA base-pairing interactions », J Mol Biol, vol. 222, , p. 219-232 (PMID 1960724, DOI 10.1016/0022-2836(91)90208-N)
- (en) D. Fortner, G. Troy, D. Brow, « A stem loop in U6 RNA defines a conformational switch required for pre-mRNA splicing », Genes & Development, vol. 8, , p. 221-233
- (en) S.Stevens, I. Barta, H. Ge, R. Moore, M. Young, T. Lee, Abelson J, « Biochemical and genetic analyses of the U5, U6, and U4/U6•U5 small nuclear ribonucleoproteins from Saccharomyces cerevisiae », RNA, vol. 7, , p. 1543-1553
- (en) A. Jandrositz, C. Guthrie, « Evidence for a Prp24 binding site in U6 snRNA and in a putative intermediate in the annealing of U6 and U4 snRNAs », The EMBO Journal, vol. 14, , p. 820-832
- (en) K. Shannon, C. Guthrie, « Suppressors of a U4 snRNA mutation define a novel U6 snRNP protein with RNA-binding motifs », Genes & Development, vol. 5, , p. 773-785
- (en) A. Ghetti, M. Company, J. Abelson J, « Specificity of Prp24 to RNA: A role for Prp24 in the dynamic interaction of U4 and U6 snRNAs », RNA, vol. 1, , p. 132-145
- (en) R. Karaduman, P. Dube, S. Holger, « Structure of yeast U6 snRNPs: Arrangement of Prp24p and the LSm complex as reveled by electron microscopy », RNA, vol. 14, , p. 1-10