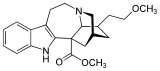
18-Methoxycoronaridine
La 18-méthoxycoronaridine (18-MC) est un dérivé de l'ibogaïne inventé en 1996 par l'équipe de recherche autour du pharmacologue Stanley D. Glick de l'Albany Medical College et du chimiste Martin E. Kuehne de l'Université du Vermont. Dans les études animales, il s'est avéré efficace pour réduire l'auto-administration de morphine, de cocaïne, de méthamphétamine, de nicotine et de saccharose[1] - [2]. 18-MC est un antagoniste nicotinique α 3 β 4, contrairement à l'ibogaïne, n'a aucune affinité au sous-type α 4 β 2 ni aux canaux NMDA ni au transporteur de sérotonine[3], et a une affinité significativement réduite pour les canaux sodium et pour le récepteur σ, mais conserve une affinité modeste pour les récepteurs μ-opioïdes où il agit comme un agoniste[4], et des récepteurs κ-opioïdes[5]. Les sites d'action dans le cerveau comprennent l'habénule médiale, le noyau interpédonculaire[6] - [7] - [8], tegmentum dorsolatéral et l'amygdale basolatérale[2]. Il a également été démontré qu'il produit des effets anorexigènes chez les rats obèses, probablement en raison des mêmes actions sur le système de récompense qui sous-tendent ses effets anti-addictifs contre la toxicomanie[9].
18-MC est aux premiers stades de tests sur l'homme par la société californienne de développement de médicaments Savant HWP[10]. En 2002, l'équipe de recherche a commencé à collecter des fonds pour des essais sur l'homme, mais n'a pas pu 'obtenir les 5 millions de dollars nécessaires[11]. En 2010, Obiter Research, un fabricant de produits chimiques de Champaign, dans l'Illinois, a signé une licence de brevet avec Albany Medical College et l'Université du Vermont, leur donnant le droit de synthétiser et de commercialiser le 18-MC et d'autres congénères. En 2012, le National Institute on Drug Abuse a accordé une subvention de 6,5 millions de dollars à Savant HWP pour des essais sur l'homme. En 2017, il est entré dans des essais de phase II au Brésil pour le traitement de la leishmaniose à l'Institut Evandro Chagas[12] mais n'a pas été approuvé dans le traitement de la toxicomanie.
Un certain nombre de dérivés du 18-MC ont été développés, plusieurs d'entre eux étant supérieurs au 18-MC lui-même, le congénère méthoxyéthyle ME-18-MC étant plus puissant que le 18-MC avec une efficacité similaire, et l'analogue méthylamino 18-MAC étant plus efficace que le 18-MC avec à peu près la même puissance. On a également découvert que ces composés agissaient comme des antagonistes sélectifs de l'acétylcholine nicotinique α 3 β 4, avec peu ou pas d'effet sur les récepteurs NMDA[13] - [14].
Notes et références
- « 18-Methoxycoronaridine, a non-toxic iboga alkaloid congener: effects on morphine and cocaine self-administration and on mesolimbic dopamine release in rats », Brain Research, vol. 719, nos 1–2, , p. 29–35 (PMID 8782860, DOI 10.1016/0006-8993(96)00056-X)
- « Brain regions mediating alpha3beta4 nicotinic antagonist effects of 18-MC on methamphetamine and sucrose self-administration », European Journal of Pharmacology, vol. 599, nos 1–3, , p. 91–5 (PMID 18930043, PMCID 2600595, DOI 10.1016/j.ejphar.2008.09.038)
- « Anti-addictive actions of an iboga alkaloid congener: a novel mechanism for a novel treatment », Pharmacology, Biochemistry, and Behavior, vol. 75, no 3, , p. 607–18 (PMID 12895678, DOI 10.1016/S0091-3057(03)00119-9)
- « Effect of Iboga alkaloids on µ-opioid receptor-coupled G protein activation », PLOS ONE, vol. 8, no 10, , e77262 (PMID 24204784, PMCID 3818563, DOI 10.1371/journal.pone.0077262, Bibcode 2013PLoSO...877262A)
- Glick SD, Maisonneuve IM, Hough LB, Kuehne ME, Bandarage UK. (±)-18-Methoxycoronaridine: A Novel Iboga Alkaloid Congener Having Potential Anti-Addictive Efficacy. CNS Drug Reviews 1999;5(1):27-42.
- « 18-Methoxycoronaridine acts in the medial habenula and/or interpeduncular nucleus to decrease morphine self-administration in rats », European Journal of Pharmacology, vol. 537, nos 1–3, , p. 94–8 (PMID 16626688, DOI 10.1016/j.ejphar.2006.03.045)
- « 18-MC acts in the medial habenula and interpeduncular nucleus to attenuate dopamine sensitization to morphine in the nucleus accumbens », Synapse, vol. 61, no 7, , p. 547–60 (PMID 17447255, DOI 10.1002/syn.20396)
- « Morphine-induced changes in acetylcholine release in the interpeduncular nucleus and relationship to changes in motor behavior in rats », Neuropharmacology, vol. 53, no 1, , p. 18–26 (PMID 17544456, PMCID 2025684, DOI 10.1016/j.neuropharm.2007.04.010)
- « 18-methoxycoronaridine: a potential new treatment for obesity in rats? », Psychopharmacology, vol. 201, no 3, , p. 339–50 (PMID 18751969, PMCID 3787601, DOI 10.1007/s00213-008-1290-9)
- Albany Med scientist closer to addiction drug success timesunion.com June 27, 2014.
- Addiction Treatment Strives for Legitimacy. Journal of the American Medical Association. 2002; 288: 3096-3101.
- « Phase 2 Trial to Evaluate 18-Methoxycoronaridine Efficacy, Safety and Tolerability in Cutaneous Leishmaniasis Patients », ClinicalTrials.gov (consulté le )
- « Synthesis and biological evaluation of 18-methoxycoronaridine congeners. Potential antiaddiction agents », Journal of Medicinal Chemistry, vol. 46, no 13, , p. 2716–30 (PMID 12801235, DOI 10.1021/jm020562o)
- « Novel iboga alkaloid congeners block nicotinic receptors and reduce drug self-administration », European Journal of Pharmacology, vol. 492, nos 2–3, , p. 159–67 (PMID 15178360, DOI 10.1016/j.ejphar.2004.03.062)