Titrage complexométrique
Le titrage complexométrique (aussi qualifié de chélatométrique) est une forme de titrage dans laquelle on transforme un ion libre en complexe coloré. Les titrages complexométriques sont particulièrement utiles pour la détermination d'un mélange de différents ions métalliques en solution. On utilise un Indicateur de complexométrie capable de produire un changement de couleur net pour détecter le point final du titrage. Les titrages complexométriques sont souvent réalisés en retour, car les ions métalliques libres en solution vont se complexer avec l'indicateur. Le point d'équivalence est déterminé lors du changement net de couleur de la solution ; on ne pourra donc plus complexer les ions libres qui seront en majorité dans la solution. On peut aussi utiliser pour déterminer ce point le titrage conductimétrique.
Conditions
Toute réaction de complexation peut, en théorie être utilisée comme support de dosage, si elle suit les règles suivantes :
- La réaction doit être rapide et totale.
- Aucune réaction perturbatrice ne doit se produire en même temps. Par exemple, la formation par étapes de plusieurs complexes différents de l'ion métallique (que l'on veut titrer) avec le titrant, produit plus d'un complexe en solution pendant le processus de titrage, ce qui rend faux la lecture de l'équivalence.
- L'indicateur complexométrique, doit être capable de déterminer le point d'équivalence avec une bonne précision, sa zone de virage doit être lisible.
En pratique, l'EDTA est souvent utilisé comme titrant.
Titrage avec l'EDTA
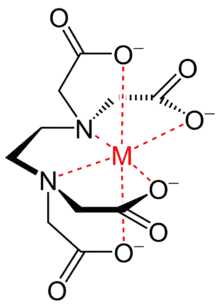
L'EDTA, acide éthylènediaminetétraacétique, a quatre groupes carboxyle et deux groupes amine qui peuvent agir comme donneurs d'électrons, grâce aux doublets non liants (une paire d'électrons non liante) de l'oxygène et de l'azote, aussi appelé bases de Lewis. L'EDTA est un ligand hexadentate car il peut au maximum donner ses six paires d'électrons pour former des liaisons covalentes avec les cations métalliques. Cependant, en pratique à cause de sa symétrie et sa géométrie, l'EDTA n'est généralement que partiellement ionisé et forme ainsi moins de six liaisons covalentes.