Spectroscopie à corrélation croisée de fluorescence
La spectroscopie de corrélation croisée de fluorescence (SCCF) a été introduite en 1994 par Eigen et Rigler[1] et appliquée expérimentalement en 1997 par Petra Schwille[2]. Il s'agit essentiellement d'une extension de la méthode de spectroscopie de corrélation de fluorescence (SCF) consistant à utiliser deux molécules de couleurs distinctes, au lieu d'une seule. En d'autres termes, les fluctuations d'intensité verte et rouge de molécules distinctes sont corrélées si les particules marquées vert et rouge se déplacent ensemble dans un volume confocal prédéfini. En conséquence, la SCCF permet de mesurer avec une haute sensibilité les interactions moléculaires indépendamment du taux de diffusion. Il s'agit d'un progrès important, dû au fait que le taux de diffusion ne dépend que faiblement de la taille du complexe moléculaire[3].
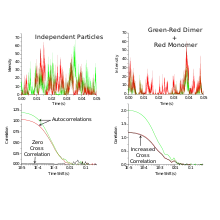
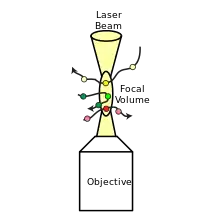
La SCCF utilise deux espèces qui sont marquées indépendamment avec deux sondes fluorescentes de couleurs différentes. Ces sondes fluorescentes sont excitées et détectées par deux sources de lumière laser et détecteurs différents, généralement étiquetés « verts » et « rouges ». Généralement, un microscope confocal est utilisé pour fournir des volumes focaux vert et rouge qui se chevauchent pour l'excitation.
où les signaux fluorescents différentiels à un temps donné et à un temps décalé de sont corrélés. En l'absence de recouvrement spectral, la fonction de corrélation croisée est nulle pour les particules qui n'interagissent pas. Contrairement au SCF, la fonction de corrélation croisée augmente avec l'augmentation du nombre de particules en interaction.
La SCCF est principalement utilisé pour la mesure des interactions biomoléculaires que ce soit dans les cellules vivantes ou in vitro[4] - [5]. Elle peut être utilisée pour mesurer des stœchiométries moléculaires simples et des constantes de liaison[6]. Il s'agit de l'une des rares techniques qui peuvent fournir des informations sur les interactions entre protéines à un moment et à un endroit précis dans une cellule vivante. Contrairement au transfert d'énergie entre molécules fluorescentes, elle n'a pas de limite de distance pour les interactions. En conséquence, elle peut être utilisée pour sonder de grands complexes. Néanmoins, cela nécessite que les complexes diffusent activement à travers le foyer du microscope sur une échelle de temps relativement courte (généralement quelques secondes).
Modélisation
Les courbes de corrélation croisée sont modélisées par une fonction mathématique légèrement plus compliquée que celle appliquée dans le cadre de la SCF. Tout d'abord, le volume d'observation superposé effectif dans lequel les canaux V et R forment un seul volume d'observation, dans la solution :
où and sont les paramètres radiaux et and les paramètres axiaux, respectivement pour les canaux V et R.
Le temps de diffusion, pour une espèce doublement fluorescente (V et R) est donc décrite comme suit :
où est le coefficient de diffusion des particules doublement fluorescentes.
La courbe de corrélation croisée générée par la diffusion de particules fluorescentes doublement marquées peut être modélisée dans des canaux séparés comme suit :
Dans le cas idéal, la fonction de corrélation croisée est proportionnelle à la concentration du complexe fluorescent doublement marqué :
avec
L'amplitude de la corrélation croisée est directement proportionnelle à la concentration d'espèces à double marquage (« rouge » et « vert »)[2].
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Fluorescence cross-correlation spectroscopy » (voir la liste des auteurs).
- Eigen, M. and Rigler, R. Sorting single molecules: Application to diagnostics and evolutionary biotechnology. (1994) Proc. Natl. Acad. Sci. U.S.A. 91, 5740-5747.
- Petra Schwille, Franz-Josef Meyer-Almes, Rudolf Rigler, Dual-color fluorescence cross-correlation spectroscopy for multicomponent diffusional analysis in solution. (1997) Biophys. J. 72, 1878-1886.
- Itoh, K.; Isobe, K.; Watanabe W. Functional Imaging by Controlled Nonlinear Optical Phenomena. (2013) John Wiley & Sons
- Bacia, K.; Kim, S.A.; Schwille, P. Fluorescence cross-correlation spectroscopy in living cells. (2006) Nat. Meth. 3, 83-89 .
- Slaughter, B. D.; Unruh, J. R.; Li, R. Fluorescence fluctuation spectroscopy and imaging methods for examination of dynamic protein interactions in yeast. In Methods in Molecular Biology: Yeast Systems Biology. J.I. Castrillo and S.G. Oliver, Eds. (Springer, New York, 2011). Vol. 759, pp. 283-306.
- Chen, Y. and Mueller, J.D. Determining the stoichiometry of protein heterocomplexes in living cells with fluorescence fluctuation spectroscopy. (2006) Proc. Natl. Acad. Sci. U.S.A. 104, 3147-3152.

















