Microscopie à conductance ionique
La microscopie à conductance ionique (Scanning Ion Conductance Microscopy (SICM), en anglais) est une technologie de microscopie à sonde locale développée par Paul Hansma et al. en 1989[1]. Il s'agit d'une technique permettant de déterminer la topographie d'un échantillon en milieu aqueux contenant des électrolytes, à une résolution micro- voire nanométrique[2].
La SICM permet de caractériser des échantillons de matériaux non conducteurs pouvant être souples, un des intérêts principaux de cette mesure étant que la sonde n'entre pas directement en contact avec l'échantillon, ce qui permet de ne pas le détruire ni de déformer la surface. Cela rend possible l'observation de tissus biologiques et de cellules vivantes. Cette technique est capable de reproduire fidèlement des profils ayant des reliefs ou des crevasses abruptes[3], et a aussi été utilisée pour étudier la mobilité de cellules vivantes pendant leur migration[4].
Principe de fonctionnement
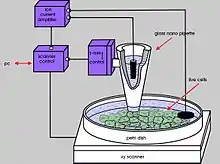
La SICM utilise le changement de résistance d'accès à une électrode dans une micro ou nano-pipette quand cette dernière est approchée près d'un échantillon. Le dispositif observe le courant ionique passant par la pointe de la micro/nano-pipette, courant qui décroît quand la pointe est suffisamment proche de l'échantillon pour que le flux d'ions soit entravé par la trop grande proximité de la surface.
Une différence de potentiel est appliquée entre les deux électrodes Ag/AgCl, l'une étant dans la micro-pipette et l'autre dans le réservoir de solution. Cette différence de potentiel génère un courant ionique, donc un flux d'ions entrant et sortant de la micro-pipette. La conductance (et indirectement la résistance) entre les deux électrodes est mesurée, et dépend du flux d'ions en solution.
Les mouvements de la pipette se font à l'aide de matériaux piezoélectriques. La micro-pipette est approchée de la surface jusqu'à ce que la proximité de l'échantillon réduise le flux d'ions à l'entrée de la pipette. À cet instant la résistance du circuit va augmenter puisque la conductance décroît. Lorsque la résistance atteint un seuil préétabli, la descente de la pipette est arrêtée et sa position enregistrée. La pipette est ensuite déplacée (de différentes façons selon le mode de mesure utilisé) et une seconde mesure est effectuée. À l'aide de toutes les mesures la topographie en trois dimensions de l'échantillon est reconstituée. Une caractéristique majeure du système est que la pointe de la pipette est immobilisée avant qu'elle n'entre en contact avec la surface de l'échantillon, ce qui permet de ne pas le déformer ni de l'abîmer. C'est un des avantages majeurs de la SICM par rapport aux autres techniques de microscopie à sonde locale.
Circuit électrique équivalent
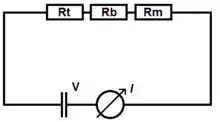
La résistance totale du circuit (Rt) est la somme des trois résistances suivantes[5] :
- Rb : résistance de la solution d'électrolytes entre l'entrée de la pipette et l'électrode dans le réservoir[5] ;
- Re : résistance de la solution d'électrolytes entre l'entrée de la pipette et l'électrode dans la micro-pipette[5] ;
- Rd : résistance d'entrée de la micro-pipette[5].
Pour un dispositif donné, tous les paramètres du système sont constants à l'exception de la résistance d'entrée de la micro-pipette, qui est une fonction de la distance d entre l'échantillon et le bout de la pipette. C'est donc la variation de Rd selon d qui sera utilisée pour déterminer la topographie de l'échantillon[5].
Approximations habituelles
La chute de tension à la surface des électrodes Ag/AgCl est négligée car on considère qu'elle est constante et négligeable par rapport à la chute de tension à l'entrée de l'électrode. Rb est considérée constante car sa variation est proportionnellement très faible vu que la distance entre l'entrée de la micro-pipette et l'électrode dans le réservoir est très grande par rapport au mouvement lors d'une mesure.
Avantages et inconvénients
La SICM possède des avantages et inconvénients par rapport à d'autres techniques de microscopie à sonde locale.
- La SICM possède une résolution d'un ordre de grandeur moins précise que celles offertes par les techniques AFM et STM, qui atteignent régulièrement des résolutions de l'ordre de 0,1 nm. La résolution des mesures de SICM est en théorie[6], limitée à au minimum 1,5 fois le diamètre de l'entrée de la micro-pipette. Cependant, des mesures avec une résolution autour de 3-6 nm ont été obtenues avec une nanopipette de diamètre d'entrée de 13 nm[7].
- Cette technique est utilisable pour la caractérisation de surfaces peu ou pas conductrices, ce qui est impossible avec le STM[5].
- Lors d'une mesure SICM, la micro-pipette ne touche jamais la surface de l'échantillon ; cela permet la caractérisation d'échantillons souples (cellules, échantillons biologiques, microvillosités) sans les déformer[8] - [9] - [10].
- La SICM se fait dans une solution électrolytique, donc est utilisable en milieu physiologique ce qui rend l'observation de cellules vivantes et de processus biologiques possible en direct[10].
- En hopping mode (cf. plus bas) on peut caractériser une surface ayant des reliefs et des crevasses profondes.
Modes de fonctionnement
Il existe quatre modes de fonctionnement principaux en SICM.
Mode à altitude constante (constant-z mode)
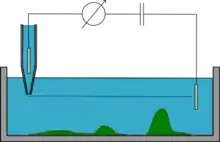
La micro-pipette est maintenue à une altitude constante (position z constante) pendant qu'elle balaye la surface de l'échantillon et la résistance du système est mesurée pour en reconstituer la topographie. Ce mode permet de faire des mesures rapides, mais n'est possible qu'avec des échantillons très plats et est très rarement utilisé. Si la micro-pipette est placée trop près de l'échantillon elle risque de le heurter et de l'abîmer, et à l'inverse si elle est positionnée trop loin l'échantillon ne sera pas observé.
Mode courant continu (DC mode)
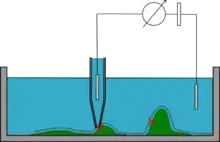
La micro-pipette est approchée de l'échantillon jusqu'à ce que la résistance mesurée atteigne une valeur prédéfinie. La micro-pipette est alors balayée le long de la surface de l'échantillon, en utilisant une boucle de rétroaction pour maintenir constante la distance entre l'entrée de la micro-pipette et la surface. La position en z de la pipette est enregistrée et permet de reconstituer la topographie de l'échantillon. Ce mode ne permet pas de détecter des protrusions hautes et risque de heurter l'échantillon dans cette situation. Ce mode est aussi sujet aux dérives de potentiel d'électrode (electrode drift).
Mode courant alternatif (AC mode)
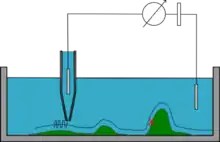
La micro-pipette oscille sinusoïdalement avec une faible amplitude en plus du mouvement de balayage. Lorsque la pipette est loin de la surface de l'échantillon la résistance est stable ; lorsque la résistance commence à osciller, l'amplitude sert de feedback pour moduler la position, jusqu'à ce que l'amplitude atteigne une valeur prédéfinie[8] - [9].
La réponse de la partie alternative du courant est beaucoup plus rapide que celle de la partie continue, ce qui permet une plus grande réactivité aux reliefs et la caractérisation d'échantillons plus complexes.
Mode Hopping/backstep approach
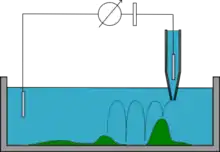
Dans ce mode la micro-pipette est approchée de la surface de l'échantillon jusqu'à ce que la résistance atteigne une valeur prédéfinie, et la position est enregistrée. Ensuite, la pipette est remontée loin de la surface, bougée latéralement, rabaissée et une nouvelle mesure est faite. À la fin de l'expérience la topographie de l'échantillon est reconstituée. Ce mode est plus lent que les autres mais permet de caractériser des échantillons avec des géométries très inégales, voire des cellules entières, sans en déformer la surface[11] - [12].
Synergies avec d'autres techniques de mesures
La SICM a permis de caractériser une cellule neurale de cerveau de rat[4], déterminer le cycle de vie de microvillosités[8], et d'observer le mouvement de complexes de protéines dans des spermatozoïdes[2], entre autres. Elle a été combinée à la microscopie à fluorescence[2], et au transfert d'énergie entre molécules fluorescentes (FRET, Förster Resonance Energy Transfer)[13]. Elle a également pu être utilisée dans un smart patch-clamp où la pipette fait un effet ventouse sur la paroi d'une cellule, pour observer les flux dans les canaux ioniques (ion sodium) de la membrane cellulaire[14].
Une combinaison de SICM et AFM a permis d'obtenir des images à haute résolution de membranes synthétiques en solution[15].
La microscopie optique en champ proche a été couplée à la SICM pour faire des mesures de fluorescence sans photoblanchiment[16] - [17].
Récemment, la FSICM (Fast SICM) a été mise au point, améliorant grandement la rapidité de mesures en hopping mode[18].
Références
- (en) P.K. Hansma, B. Drake, O. Marti, S.A. Gould et C.B. Prater, Science 243, 641 (1989)
- (en) Shevchuk, A.I. ; Frolenkov, G.I. ; Sánchez, D. ; James, P.S. ; Freedman, N. ; Lab, M.J. ; Jones, R. ; Klenerman, D. ; Korchev, Y.E., « Imaging proteins in membranes of living cells by high-resolution scanning ion conductance microscopy », Angew. Chem. Int. Ed. Engl., 2006, 45, 2212–2216.
- (en) Rheinlaender, J. ; Geisse, N.A. ; Proksch, R. ; Schäffer, T.E., « Comparison of scanning ion conductance microscopy with atomic force microscopy for cell imaging », Langmuir 2011, 27, 697–704.
- (en) Happel, P. ; Wehner, F. ; Dietzel, I.D., « Scanning ion conductance microscopy–a tool to investigate electrolyte-nonconductor interfaces », Modern Research and Educational Topics in Microscopy, FORMATEX : Badajoz, Espagne, 2007, p. 968–975.
- (en) Chen, C.C., Zhou, Y., Baker, L.A. (2012), « Scanning ion conductance microscopy », Annual Review of Analytical Chemistry, 5, 207-228.
- (en) Rheinlaender, J.; Schäffer, T.E. Image formation, resolution, and height measurement in scanning ion conductance microscopy. J. Appl. Phys. 2009, 105, 094905.
- (en) Shevchuk, A.I.; Frolenkov, G.I.; Sánchez, D.; James, P.S.; Freedman, N.; Lab, M.J.; Jones, R.; Klenerman, D.; Korchev, Y.E. Imaging proteins in membranes of living cells by high-resolution scanning ion conductance microscopy. Angew. Chem. Int. Ed. Engl. 2006, 45, 2212–2216.
- (en) Gorelik, J.; Shevchuk, A.I.; Frolenkov, G.I.; Diakonov, I.A.; Lab, M.J.; Kros, C.J.; Richardson, G.P.; Vodyanoy, I.; Edwards, C.R.W.; Klenerman, D. et al., Dynamic assembly of surface structures in living cells. Proc. Natl. Acad. Sci. USA 2003, 100, 5819–5822.
- (en) Gorelik, J.; Zhang, Y.; Shevchuk, A.I.; Frolenkov, G.I.; Sánchez, D.; Lab, M.J.; Vodyanoy, I.; Edwards, C.R.W.; Klenerman, D.; Korchev, Y.E. The use of scanning ion conductance microscopy to image A6 cells. Mol. Cell Endocrinol. 2004, 217, 101–108.
- (en) Zhang, Y.; Gorelik, J.; Sanchez, D.; Shevchuk, A.; Lab, M.; Vodyanoy, I.; Klenerman, D.; Edwards, C.; Korchev, Y. Scanning ion conductance microscopy reveals how a functional renal epithelial monolayer maintains its integrity. Kidney Int. 2005, 68, 1071–1077.
- (en) Mann, S.A.; Hoffmann, G.; Hengstenberg, A.; Schuhmann, W.; Dietzel, I.D. Pulse-mode scanning ion conductance microscopy—A method to investigate cultured hippocampal cells. J. Neurosci. Methods 2002, 116, 113–117.
- (en) Novak, P.; Li, C.; Shevchuk, A.I.; Stepanyan, R.; Caldwell, M.; Hughes, S.; Smart, T.G.; Gorelik, J.; Ostanin, V.P.; Lab, M.J. et al., Nanoscale live-cell imaging using hopping probe ion conductance microscopy. Nat. Methods 2009, 6, 279–281.
- (en) Nikolaev, V.O. ; Moshkov, A. ; Lyon, A.R. ; Miragoli, M. ; Novak, P. ; Paur, H. ; Lohse, M.J. ; Korchev, Y.E. ; Harding, S.E. ; Gorelik, J., « Beta2-adrenergic receptor redistribution in heart failure changes cAMP compartmentation », Science 2010, 327, 1653–1657.
- (en) Duclohier, H., « Neuronal sodium channels in ventricular heart cells are localized near T-tubules openings », Biochem. Biophys. Res. Commun., 2005, 334, 1135–1140.
- (en) R. Proksch, R. Lal, P.K. Hansma, D. Morse et G. Stucky, Biophysical Journal 71, 2155 (1996)
- (en) A. Bruckbauer, L. Ying, A.M. Rothery, Y.E. Korchev et D. Klenerman, Analytical Chemistry 74, 2612 (2002)
- (en) A.M. Rothery, J. Gorelik, A. Bruckbauer, W.Yu, Y.E. Korchev et D. Klenermann, Journal of Microscopy 209, 94
- (en) Zhukov, A. ; Richards, O. ; Ostanin, V. ; Korchev, Y. ; Klenerman, D. A, « Hybrid scanning mode for fast scanning ion conductance microscopy (SICM) imaging », Ultramicroscopy 2012, 121C, 1–7.