Implant rétinien
Un implant rétinien est un implant électronique qui substitue les photorécepteurs[1] se fixant au niveau de la rétine afin de restaurer partiellement la vision.
Description
Les implants consistent en une grille d'électrodes implantée au niveau de la rétine. Il existe deux types d'implants rétiniens : les implants épirétiniens (sur la rétine) et les implants subrétiniens (derrière la rétine)
Implant épirétinien
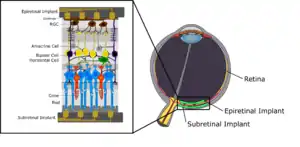
Ce type d'implant est utilisé lorsque les couches internes et moyennes de la rétine sont endommagées. Le système est destiné à compenser la dégénérescence des cellules photoréceptrices de la rétine (bâtonnets et cônes).
Pour ce faire, des caméras numériques sont intégrées dans une paire de lunettes que doit porter le patient. Ces dernières transmettent les informations visuelles à un micro-ordinateur placé dans la poche ou à la ceinture du patient qui les convertit en codes de signaux électriques qui sont eux-mêmes transmis par ondes radio à un récepteur placé sur l’œil. Enfin, ce signal est traduit en courants électriques qui progressent sur la natte de fils pénétrant dans l’œil pour finalement atteindre l'implant composé d'électrodes et fixé sur la rétine.
Ces implants se substituent donc aux photorécepteurs de la rétine : ils stimulent les neurones rétiniens par le biais d'électrodes (jusqu'à 1500 de nos jours contre 16 à 20 il y a une trentaine d'années.)[1]
Exemples d'implants épirétiniens : Argus II (Second sight, Etats-Unis) et IRIS II (Pixium Vision, France)
Implant subrétinien
L’implant subrétinien est utilisé quand seule la couche externe de la rétine est endommagée. Le système est, tout comme l’implant épi-rétinien, destiné à compenser la dégénérescence des cellules photoréceptrices de la rétine (bâtonnets et cônes). C’est le projet le plus récent concernant l’œil bionique, les premiers projets ayant vu le jour au début des années 2000.
En général ce type d'implant est bien moins encombrant que l'épirétinien, car il ne nécessite pas de porter des lunettes. Il existe toutefois un implant subrétinien, PRIMA, développé par Pixium Vision, qui nécessite lui aussi le port de lunettes avec des caméras intégrées. Seul le fonctionnement des implants subrétiniens qui ne nécessitent pas de lunettes est expliqué ici, car l'implant PRIMA a un fonctionnement similaire à celui d'un implant épirétinien.
L’implant contient des micro-photodiodes qui captent la lumière incidente et la convertissent en signaux électriques directement transmis aux cellules rétiniennes sous-jacentes par l’intermédiaire de micro électrodes. En général ce système possède une alimentation externe, située derrière l'oreille afin d'améliorer l'image obtenue. La pose de ce câble rend l'opération plus complexe que pour un implant épirétinien où le système n'a pas de fil qui sorte de l’œil.
Ce système est donc moins encombrant, mais le nombre de patients pouvant le recevoir est plus faible et il est plus délicat à poser.
Exemples d'implants subrétiniens : Retina Implant (AG, Allemagne), ASR (Optobionics), PRIMA (Pixium Vision)
Traitement
Bénéficiaires
Ces dispositifs s'adressent aux personnes aveugles dont les cellules photoréceptrices ont dégénéré mais chez qui les cellules nerveuses et le nerf optique demeurent fonctionnels. On parle là notamment de sujets atteints de rétinopathie pigmentaire, de dystrophie rétinienne ou encore de dégénérescence maculaire liée à l'âge.
Sur le plan médical, l'opération implique d'avoir un œil en bon état et de ne présenter aucune autre maladie oculaire. Des examens se doivent d'être effectués pour vérifier que l'espace entre l'œil et la paroi de l'orbite est suffisant pour y insérer le récepteur. Qui plus est, d'un point de vue psychologique, le patient se doit de présenter un certain enthousiasme, tout en restant réaliste.
À ce jour, le nombre d'implants posés est très faible par rapport au nombre de personnes atteintes de ces maladies. En France, en 2016, il y avait 30 000 cas de rétinopathie pigmentaire recensés, mais seulement 36 personnes ont été implantées de l'Argus II. Il y a plusieurs raisons qui expliquent cela : seulement trois hôpitaux (le CHNO des Quinze-Vingts à Paris, le CHU de Bordeaux et le CHU de Strasbourg) réalisent ces opérations, ce qui limite déjà le nombre de patients susceptibles d'en recevoir un. Le prix de 90 000€ est aussi un frein au développement à plus grande échelle de ces appareils, même si en France le ministère de la santé finance cela.
Les implants sont posés chez des patients en stade terminal de dégénérescence rétinienne, mais les médecins estiment que des implantations sur des personnes plus jeunes auraient de meilleurs résultats. Le milieu médical est en attente d'essais cliniques pour le prouver.
Ré-éducation
À la suite de l'opération, une période de ré-éducation en trois temps est indispensable. Dans un premier temps, les patients sont gardés un mois pour régler la caméra et l'intensité des signaux électriques. Chaque électrode doit être testée 40 fois. La véritable ré-éducation débute au bout de six mois. Elle s'effectue par le biais de plusieurs heures quotidiennes d'exercices. Les patients doivent apprendre une nouvelle façon de voir, en associant et en ordonnant les signaux lumineux perçus. Le patient doit savoir utiliser sa vision, qui s'effectue par points lumineux, afin de se repérer plus facilement et d'analyser son environnement.
Vie après l'implant
Les patients, après intervention, arrivent à percevoir des signaux lumineux, mais pas les couleurs. Certains peuvent se déplacer seuls, repérer une porte ou une fenêtre dans une pièce, visualiser des passages piétons ou encore suivre une ligne sur le sol. D'autres même parviennent à lire, sur un écran d'ordinateur des mots à gros caractères, blancs sur fond noir. Les résultats varient cependant de manière importante de patient en patient. Dans tous les cas, les patients ne retrouvent pas leur vision d'antan.
Les résultats varient beaucoup d'un patient à l'autre, mais globalement les résultats sont satisfaisants[2].
Commercialisation
Pixium Vision
En France, la compagnie Pixium Vision a réalisé l'innovation du PRIMA Bionic Vision System [3] - [4], une nouvelle génération d'implant subrétinien. L'implant a été installé chez cinq patients[5] en France souffrant d'une perte de vision grave, qui l'ont adopté à la suite de résultats concluants[6] - [7]. Ceci a donc permis à ceux-ci de rentrer en phase de ré-éducation. Le dispositif utilisé est doté de 378 électrodes. Le système fonctionne par le biais d'une micro-caméra installée sur la paire de lunettes portée par le patient. Les informations visuelles enregistrées par la caméra sont converties en signaux lumineux captés par l'implant, qui se substitue à la rétine défaillante.
Second Sight Vision
Avec plus d'expérience dans la recherche oculaire, Second Vision, une compagnie américaine a développé l'Argus® II Retinal Prosthesis System, permettant de restaurer la vision chez les personnes aveugles. L'utilisation de ce produit a été approuvé dans le secteur économique Américain et Européen. Ce produit est intéressant car il combine vision artificielle et naturelle. En effet les images électroniques du centre de l’œil fonctionne avec les cellules de la rétine. Elle permet ainsi aux patients de s’orienter, ainsi que d’appréhender et d’éviter les obstacles rencontrés lors des déplacements.
Recherches
État actuel de l'avancée
En France, on peut citer une quarantaine de cas de rétinite pigmentaire qui ont déjà bénéficié de l'implantation du système Argus II, notamment grâce au ministère de la santé qui assure le financement du dispositif (Environ 90 000 euros par intervention).
Futur et enjeux des recherches
L'objectif à terme est de proposer un œil bionique qui permette de reconnaître des visages, de lire ou encore de se déplacer en parfaite autonomie. Pour ces tâches complexes, des études suggèrent qu'une résolution d'au moins 600 à 1000 pixels serait suffisante. Une perception des couleurs serait aussi une avancée énorme.
La société Pixum Vision travaille d'ores et déjà sur des implants nouvelle génération qui individualisent le signal émis par chaque électrode pour activer spécifiquement les cellules ganglionnaires et donc augmenter la résolution spatiale du nouvel implant.
Un autre biais de recherche est celui des électrodes en elle-même. En effet, si l'on augmente leurs performances, on ne peut qu'améliorer la qualité des implants. Les chercheurs pensent à l'heure actuelle à remplacer les matériaux en date (polymères, métaux) par des nouveaux tels que le graphène et le diamant. Ce dernier, extrêmement stable, possède d'excellentes propriétés de semi-conducteur et une extrême biocompatibilité.
En plus de ces aspects techniques, un des enjeux majeurs est d'augmenter le nombre de patients implantés. Pour cela un il faudrait diminuer le prix, ce qui serait possible d'ici quelques années à condition que les fabricants d'implants ne se focalisent pas seulement sur les performances, mais trouvent un bon compromis entre performances et prix. Pour améliorer le développement de ces implants, des chirurgiens doivent être formés pour apprendre à pratiquer ces opérations.
De plus, il est nécessaire d'améliorer les méthodes de réhabilitation. Notamment, les cliniciens apprennent les patients à reprogrammer eux-mêmes leurs implants. Des entreprises telles que Streetlab sont très impliquées dans le développement de tels protocoles.
Notes et références
- « Rétine artificielle | Inserm », sur Inserm (consulté le )
- Témoignages de patients ayant reçu ces implants, Site Pixium
- PDF téléchargeable sur le site de Pixium Vision
- Séverine Fontaine, « Comment l’implant de Pixium Vision aide les malvoyants à recouvrer la vue ? », sur www.techniques-ingenieur.fr, (consulté le )
- "Pixium Vision implante des yeux « bioniques » à cinq patients", Les Echos, 30 aout 2018
- PDF téléchargeable sur le site de Pixium Vision
- PDF téléchargeable sur le site de Pixium Vision