FluoroSpot
Le test FluoroSpot est une modification du test ELISPOT. L’ELISPOT mesure la sécrétion d’une cytokine par une cellule dans un puits en utilisant un anticorps marqué par une enzyme spécifique à la cytokine étudiée. Le FluoroSpot mesure la sécrétion de plusieurs cytokines par une même cellule en utilisant un anticorps marqué par un fluorochrome spécifique à la cytokine étudiée. La méthode peut être appliquée à n'importe quel système où l’on souhaite étudier la double voire triple sécrétion de protéine au niveau unicellulaire.
La technique Fluorospot est intéressante si l’on a un nombre restreint de cellules et si on souhaite analyser plusieurs cytokines simultanément dans un même puits. Cette technique pourra être utilisée dans des situations telles que les cellules productrices représentent seulement une petite fraction de la population cellulaires, par exemple en étudiant des cellules T-polyfonctionnelles. Le test FluoroSpot a une sensibilité semblable à celui de l'ELISPOT traditionnel. Cette technique peut être utilisée pour analyser des réactions immunitaires polyclonales ou antigène-spécifiques aux cellules T périphériques stimulées in vivo. Comme l'ELISPOT, le FluoroSpot est simple à réaliser et approprié à des essais comprenant un nombre important d’échantillons.
Principe
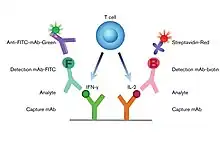
Le principe FluoroSpot (cf. figure 1) est semblable à celui de l’ELISPOT. Cependant, pour détecter des cellules qui sécrètent par exemple deux cytokines différentes, un mélange de deux anticorps de capture spécifique pour les deux cytokines est nécessaire dans chacun des puits d'une plaque à 96 puits. Après stimulation cellulaire et incubation, on enlève les cellules (lavage) puis on ajoute un mélange de deux anticorps spécifiques aux cytokines sécrétées. Pour réaliser une détection séparée des deux cytokines sécrétées, les deux anticorps spécifiques « anti-cytokine » sont conjugués avec différents marqueurs, comme la biotine et le FITC. Après un lavage pour éliminer les anticorps non liés, les cytokines sécrétées sont visualisées par l'addition d'un mélange soit de streptavidine marquée avec un fluorochrome rouge ou un anticorps pour FITC marqués avec un fluorochrome vert. La membrane du puits contiendra ainsi un mélange de taches vertes et rouges. Une cellule qui a sécrété les deux cytokines, produira ainsi une tache verte et une tache rouge localisées à la même position sur la membrane.

Pour analyser les résultats, on utilisera un lecteur automatisé FluoroSpot équipé de filtres séparés pour la fluorescence verte et rouge. L’analyse se fera par un logiciel qui lira les taches fluorescentes « simples » vertes et rouges. La « double » sécrétion se révèlera par un système de co-localisation des taches. Visuellement, les taches représentant les cellules qui auront sécrétées les deux cytokines apparaîtront en jaune (recouvrement des taches vertes et rouges cf. figure 2). La fréquence des cellules sécrétrices « simples » ou « doubles » sera déterminée en comptabilisant le nombre de taches dans les cultures de cellules stimulées et celles obtenues sans stimulus « contrôles ».
Références
- Gazagne A, et al. A Fluorospot assay to detect single T lymphocytes simultaneously producing multiple cytokines. J. Immunol. Methods 283: 91, 2003.
- Boulet S, et al. A dual color ELISPOT method for the simultaneous detection of IL-2 and IFN-γ HIV-specific immune responses. J. Immunol. Methods 320:18, 2007.
- Quast S, et al. IL-2 absorption affect IFN-γ and IL-5, but not IL-4 producing memory T cells in double color cytokine ELISPOT assays. Cell. Immunol. 237:28, 2005.
- Seder R A, et al. T cell quality in memory and protection: implications for vaccine design. Nature Reviews 8: 247, 2008.
- Smedman C, et al. FluoroSpot Analysis of TLR-Activated Monocytes Reveals Several Distinct Cytokine-Secreting Subpopulations. Scand. J. Immunol. 75(2):249, 2012.
- Chauvat A. et al. Clinical validation of IFNγ/IL-10 and IFNγ/IL-2 FluoroSpot assays for the detection of Tr1 T cells and influenza vaccine monitoring in humans. Human Vaccines & Immunotherapeutics 10(1):104, 2014.