Extraction des métaux par calcination
L’extraction des métaux par calcination est une technique analytique de séparation préparatoire visant à extraire des analytes métalliques à partir de leur matrice minérale et organique.
Elle consiste à soumettre l’échantillon à de très haute température afin de réduire la matière organique contenue dans la matrice solide en cendre. Ainsi débarrassée de la matière organique et de l’eau, l’analyse de la cendre permettra d’obtenir aisément les informations sur les différents analytes présents avec la méthode appropriée. Essentiellement, cette méthode est considérée comme point de référence pour identifier la présence relative des éléments traces[1].
Une autre technique couramment utilisée pour extraire des analytes métalliques est l’extraction des métaux par digestion acide.
Traitement de la matrice avant la calcination

Avant la calcination, il est possible de traiter l’échantillon avec certains additifs pour améliorer la procédure afin d’éliminer les pertes potentielles et/ou pour accélérer la procédure de calcination[2]. Par exemple, on peut ajouter des sels tels que le nitrate de magnésium, le carbonate de sodium et l’oxyde de magnésium pour diminuer les interactions entre l’analyte avec les parois du creuset qui agit comme sorbant. Surtout lorsque le creuset (Voir Figure 1) est composé de silice, car elle fait de la rétention de métaux contenus dans la matrice calcinée. Le creuset est un matériau réfractaire qui est capable de résister à hautes températures, ce qui est nécessaire pour pouvoir réaliser la calcination de l’échantillon. La manière de dégrader celle-ci, c’est d’utiliser de l’acide fluorhydrique, ce qui va faciliter la dissolution de l’analyte dans la solution[2].
Ceci augmente toujours le risque de contamination et entraîne des limites de détection plus élevées, car habituellement une limite de détection plus faible est meilleure qu’une limite de détection élevée puisque c’est moins sélectif[2].
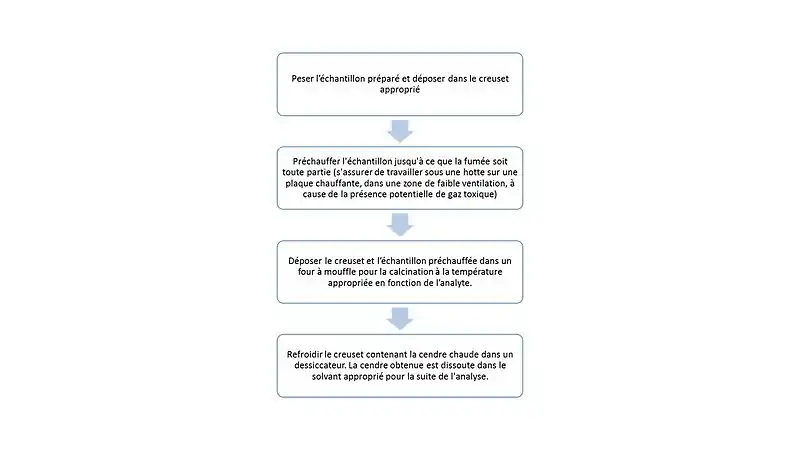
Procédure
La technique en soi est simple et facile à réaliser. Cependant, il y a de nombreux éléments à considérer pour bien la réaliser. La figure 2 montre les étapes clés de cette technique[2] - [3] - [4] - [5] - [6] - [7].
Types de traitements possibles après la calcination

Il existe plusieurs méthodes pour traiter la cendre et pouvoir enfin l’analyser à la suite de la réduction de la matrice organique qui peut être du compost, de la nourriture, des échantillons de sols contaminés, etc. En voici un exemple tiré du livre « Sample Preparation Techniques in analytical Chemistry de Wiley (2003) » qui est la préparation d’un échantillon par extraction assistée par ultrasons[2]. Pour les échantillons de sols, on dilue la cendre dans une solution aqueuse pour ensuite la bombarder d’ultrasons lors de l’extraction qui se fait 3 fois pour de meilleurs résultats. L’ultrasonication permet une dissolution effective et rapide de l’échantillon dans un solvant au lieu d’avoir un solide au fond du liquide parce que celui-ci y est peu soluble[2] - [8]. Ce concept repose sur l’agitation mécanique des cavitations (les solutés) par l’entrée d’ultrasons dans les liquides ou les solvants. Cette énergie fournie facilite et accélère le traitement de l’échantillon qui est la cendre en le dissolvant complètement avant l’analyse[8]. Cette méthode par ultrasons peut ainsi dissoudre des solutés de haute concentration en rendant la solution saturée et/ou concentrée. Cela empêche une perte importante de l’échantillon et le manque de reproductibilité de l’expérience réalisée[2] - [8]. Cette méthode donne un excellent taux de récupération d’As, Cd, Pb et Ag quand on les compare aux échantillons de référence. Aussi, ces résultats sont comparables à la digestion par micro-ondes en milieu fermé. Sinon, il y a d’autres méthodes préparatoires qui sont similaires à l’extraction des métaux par calcination telles que la digestion humide ou par micro-ondes, etc[2] - [4] - [5].
Paramètres à prendre en compte

Il y a de nombreux facteurs qui affectent la quantité d’analyte que l’on va récolter à la fin des manipulations qui sont la température à laquelle il y a réduction de la matrice, le temps durant lequel on fait chauffer l’échantillon et le type de creuset utilisé. Généralement, les températures de chauffage varient de 200 à 600 °C[6], mais dépendant du type de métaux que l’on souhaite extraire dans la matrice, car certains métaux sont assez volatils et ils peuvent être perdu lors de la calcination par volatilisation. Par exemple, l’As, Cr et Pb sont perdus par volatilisation ou adsorption sur la paroi du four à des températures varient entre 500 et 550 °C[7]. Des études présentent de fortes indications que la méthode de calcination à une température maximale de 450 °C pour le Cd, le Zn et le Fe donne des résultats exempts de pertes par volatilisation ou rétention[9], ou en dissolvant l’échantillon dans des mélanges d’acides inorganiques concentrés. Il a des limites d’utilisation du creuset en fonction de l’analyte, de la température, de type de l’aide de calcination et aussi lorsque des solutions étalons métalliques vont être calciné avec des chlorures[6]. Par exemple, dans une solution inorganique, le platine peut réagir pour former des complexes colorés[6].
Signalons que les ajouts que ce soit des acides ou des sels inorganiques pour faciliter la calcination peuvent contribuer à la contamination. Il est alors important d’utiliser des réactifs de haute pureté.
Le temps de calcination dépend de la matrice. Dans la littérature, on constate que varie entre 2-24h[5] - [7] - [9].
Il y a des risques de perte physique de l’analyte ayant une faible densité lorsqu’il a ouverture de la porte du four et des risques de contamination de l’échantillon par les poussières, puisque l’expérience se réalise en système ouvert[2].
Avantages
Cette technique présente des avantages aussi. Il est possible de réduire de grande quantité de matrice organique. Elle demande peu d’attention, peu de réactifs ainsi que de faible quantité de blanc. Il y a destruction complète de la matrice organique qui peut être nécessaire pour certaines techniques de détection telle que la spectrométrie d’émission atomique à plasma à couplage inductif (ICP-AES)[10].
Un avantage de la cendre sèche est que les cendres résultantes peuvent être dissoutes dans une petite quantité de diluant qui peut être acide, ce qui permet une meilleure détection. Elle est applicable sur une large variété d’échantillons.
Notes et références
- B.A. Malo, Partial Extraction of Metals from Aquatic Sediments, Albany, New York. U.S. Geological Survey, Central Laboratory. Vol. 11, no 3, 1997, p. 277-282.
- S. Mitra, Sample Preparation Techniques in Analytical Chemistry, New Jersey, United States : John Wiley & Sons, inc, 2003, 458 p.
- X. Wang et al., Comparison of dry ashing and wet oxydation methods for recovering articulated husk phytoliths of foxtail millet and common millet from archeological soil, Journal of Archaeological Science, Vol. 45, 2014, p. 235-239
- C.B. Williams et al., Dry ashing and microwave-induced plasma optical emission spectrometry as fast and cost-effective strategy for trace element analysis, Microchemical Journal, Vol. 132, 2017, p. 15-19
- J.W. Adrian, A Comparison of a Wet Pressure Digestion Method with Other Commonly Used Wet and Dry-ashing Methods, Colorado, United States, Vol. 98, 1973, p. 213-216
- L. Yang et al., Comparison of Dry Ashing, Wet Ashing and Microwave Digestion for determination of Trace Element in Periostracum Serpentis ans Periostracum Cicadae by ICP-AES, J. Chil. Chem. Soc., Vol. 58, no 3, 2013, p. 1877-1879
- Z.-Y. Hseu, Evaluating Heavy Metal Contents in Nine Composts Using Four Digestion Methods, Bioressource Technology, Vol. 95, 2004, p. 53-59
- C. de Luque & C. Priego, Applications Analytiques des Ultrasons, Elservier Science, 2007
- L. Jorhem, Determination of Metals in Foods by Atomic Absorption Sepctrometry after Dry Ashing : NMKL Collaborative Study, Uppsala, Sweden. Journal of AOAC International, Vol. 83, no 5, 2000, p. 1204-1211
- I. Akyar, Wide Spectra of Quality Control, Croatie, In Tech, 2011, p. 532