Charybdotoxine
La charybdotoxine (ChTx) est une toxine peptidique isolée du venin du scorpion Leiurus quinquestriatus (appelé « rôdeur mortel », en anglais Deathstalker).
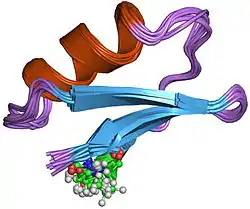
Structure
Elle est composée d'une chaine polypeptidique de 37 résidus d'acides aminés réticulée par trois ponts disulfure (masse totale 4 kDa) et a pour formule moléculaire : C176H277N57O55S7[1].
Mode d'action
La ChTx est un inhibiteur de différents canaux potassiques, y compris des canaux de conductance intermédiaire dépendants du calcium, IKCa[2]. Elle est l'homologue de l'ibériotoxine, toxine isolée du venin du scorpion rouge Hottentotta tamulus, plus sélective pour les canaux de large conductance dépendants du calcium (BK)[3].
Notes et références
- Avdonin V, Nolan B, Sabatier JM, De Waard M, Hoshi T, « Mechanisms of maurotoxin action on Shaker potassium channels », Biophys. J., vol. 79, no 2, , p. 776–87 (PMID 10920011, PMCID 1300977, DOI 10.1016/S0006-3495(00)76335-1)
- Michel Félétou, Rudi Busse, Gillian Edwards, Ingrid Fleming, Arthur H. Weston et Paul M. Vanhoutte, « Dialogue entre cellules endothéliales et cellules musculaires lisses », M/S : médecine sciences, vol. 19, no 12, , p. 1242-1250 (lire en ligne).
- Danièle Tritsch, Dominique Chesnoy-Marchais, Anne Feltz, Physiologie du neurone, France, Wolters Kluwer, , 715 p. (ISBN 978-2-7040-0872-8, lire en ligne), page 271.
Voir aussi
Bibliographie
- Goudey-Perrière Françoise, Benoit Évelyne, Goyffon Max, Marchot Pascale, Toxines et cancer, Lavoisier, , 326 p. (ISBN 978-2-7430-1953-2, lire en ligne).
Articles connexes
- Apamine, une neurotoxine du venin d"abeille.
- KCNK3, une protéine constituante d'un canal potassique à deux pores.
- Paxilline, un alcaloïde bloqueur des canaux potassiques.
- Le scorpion Pandinus imperator dont le venin contient la pandinotoxine (en), bloqueur des canaux potassiques voltage-dépendants.
Cet article est issu de wikipedia. Text licence: CC BY-SA 4.0, Des conditions supplémentaires peuvent s’appliquer aux fichiers multimédias.