Bioéquivalence
La bioéquivalence ou bio-équivalence est un terme de pharmacologie. Deux principes actifs sont dits bioéquivalents lorsque, administrés à la même concentration, ils engendrent normalement les mêmes effets.
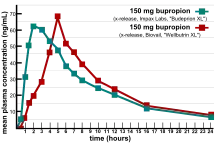
Paramètres de la bioéquivalence
- La biodisponibilité : correspond à la fraction de substance administrée par voie autre qu'intraveineuse qui sera retrouvée effectivement dans la circulation. Aptitude d'un principe actif à atteindre son ou ses sites d'action sous forme inchangée ou sous forme de métabolites actifs selon une cinétique déterminée.
- Cmax : est la concentration maximale du produit qu'on retrouvera dans le sang après administration. Par exemple un produit administré per os aura une concentration plasmatique qui augmentera jusqu'à atteindre 1mg/L puis diminuera. Dans ce cas, Cmax est égal a 1mg/L.
- Tmax : durée au bout de laquelle Cmax est atteint.
Qu’est-ce qu’une étude de bioéquivalence ? Une étude de bioéquivalence est un essai clinique qui cherche à comparer un médicament produit par deux compagnies différentes. Habituellement, un des deux médicaments est déjà commercialisé alors que l’autre ne l’est pas.
Utilisation des études de bioéquivalence
- Génériques : On définit un générique comme un médicament bio équivalent au principe actif de référence. Dès lors, pour qu'un générique soit mis sur le marché, le laboratoire qui souhaite le commercialiser doit prouver par des essais protocolisés que son générique est bio équivalent au principe de référence (cf. aux États-Unis l'amendement de 1984 au Federal Food, Drug, and Cosmetic Act).
- Innovation industrielle ou médicale, c'est-à-dire lorsque l'on veut changer de mode d'administration d'un médicament (voie orale, intraveineuse, intramusculaire, etc.) ou de posologie (administration une ou deux fois par jour...), il faut démontrer que cette innovation est bio équivalente par rapport au mode d'administration ou de la posologie de référence
Pour que l'on puisse conclure à la bioéquivalence il faut que l'intervalle de confiance à 90 % des principaux paramètres pharmacocinétiques (surface sous la courbe de la concentration plasmatique du principe actif en fonction du temps (AUC), la concentration plasmatique maximale du principe actif (Cmax), le moment où la concentration plasmatique maximale est observée (Tmax), paramètre mesurant la vitesse d’absorption de la substance active), soit compris dans la fourchette 80 % - 125 %. En général, la bioéquivalence entre deux produits ne pourra être démontrée que si les valeurs moyennes pour l’AUC et le Cmax présentent un écart de moins de 5 % entre le produit test et le produit de référence.. L'analyse statistique effectuée et exigée par les Autorités de Santé permet d'éliminer les imprécisions dues aux méthodes de dosage ainsi que la variabilité interindividuelle, c'est-à-dire la variabilité qui existe entre chaque être humain.