Équation de Davies
L'équation de Davies est une extension empirique de l'Équation de Debye–Hückel qui peut être utilisée pour calculer le coefficient d'activité d'une solution électrolyte de concentration relativement élevée.
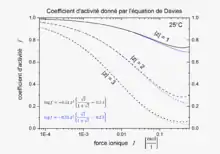
L'équation, publiée en 1938[1], a été raffinée pour correspondre aux données expérimentales. La forme finale de l'équation donne le coefficient d'activité, , d'un électrolyte qui dissocie ses ions en charges z1 et z2 suivant une fonction de force ionique, I.
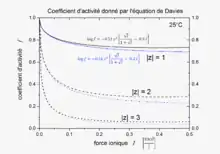
Le second terme, 0.30 I, tend vers zéro avec la force ionique, l'équation se réduisant à une équation de Debye–Hückel à faible concentration. Cependant, avec l'augmentation de la concentration, le second terme devient également important, ainsi l'équation de Davies peut être utilisée pour des solutions trop concentrées pour permettre l'utilisation d'équations de Debye–Hückel. Pour des électrolytes 1-1, la différence entre les valeurs mesurées et calculées avec cette équation est d'environ 2 % de la valeur de solutions de 0.1 M. Les calculs deviennent moins précis pour les électrolytes dissociant des ions à charges plus élevées. De plus gros écarts apparaîtront en cas d'association entre ions, avec la formation de paires d'ions, telles que Mg2+SO42−.
Loi de Davies pour l'eau à 298 K et I<0.1 M
où est le diamètre effectif moyen des ions hydratés et I la force ionique (I<0.1 M)
Voir aussi
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Davies equation » (voir la liste des auteurs).
- C.W. Davies, Ion Association, Londres, Butterworths, , p. 37-53



