Électrolyse à haute température
L'électrolyse à haute température (HTE, de l'anglais High-temperature electrolysis), ou électrolyse en phase vapeur, est une méthode étudiée pour la production d'hydrogène à partir de l'eau avec l'oxygène comme produit secondaire.
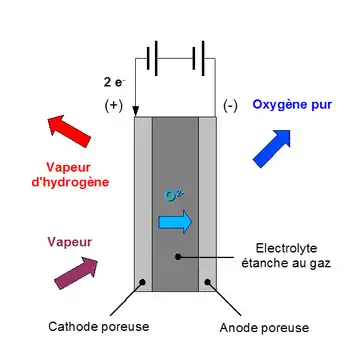
Présentation générale
Généralités
L'électrolyse sous haute température (HTE) a essentiellement deux avantages par rapport à électrolyse de l'eau à température ambiante
- les réactions chimiques sont plus faciles et plus rapides quand la température croît ;
- une partie de l'énergie nécessaire à la réaction peut être apportée par la chaleur (moins chère que l'électricité) ;
En fait, à 2 500 °C (soit 2 773 K), l'apport d'énergie thermique est suffisant et il n'y a plus besoin d'énergie électrique : l'eau se décompose en hydrogène et oxygène par une réaction de thermolyse (Il reste cependant à séparer l'hydrogène et l'oxygène produits avant qu'ils se recombinent). Une telle température (où, par comparaison, le fer est liquide et n'est pas loin de se vaporiser) n'est pas pratique, mais n'est pas nécessaire non plus. Il existe en effet des procédés thermochimiques de décomposition de l'eau en oxygène et hydrogène, comme par exemple le cycle soufre-iode, qui requière une température maximale de 830 °C. De tel procédés sont concurrents des systèmes HTE, qui doivent démontrer une supériorité à quelque point de vue pour se développer. Les systèmes HTE fonctionnent généralement entre 100 °C et 850 °C[1].
Applications
Comparaisons avec d'autres procédés
L'électrolyse à haute température est difficilement comparable avec la conversion chimique des hydrocarbures ou celle de l'énergie du charbon en hydrogène, puisqu'aucune de ces conversions n'est limitée par le rendement d'une machine thermique et que leur transformation émet du CO2. Ainsi, les sources possibles d'énergie thermique pour la HTE sont toutes non-chimiques, incluant les réacteurs nucléaires, les collecteurs d'énergie solaire et les sources géothermiques.
Si l'on dispose d'une source de chaleur à haute température peu chère, d'autres méthodes de production sont possibles. En particulier, on pourra se référer au cycle thermodynamique soufre-iode. Une production thermochimique pourrait atteindre des rendements plus intéressants que la HTE, aucune machine électrique n'étant théoriquement requise (la pratique montre que ce n'est cependant pas le cas, sur les cycles actuellement répertoriés). D'un autre côté, on pourrait argumenter qu'une production thermochimique à grande échelle nécessitera des avancées significatives dans des matériaux pouvant supporter des hautes pressions, des hautes températures, des milieux hautement corrosifs. Mais on retrouve hélas ces difficultés pour l'électrolyse haute température (les phénomènes sont moins prononcés mais plus difficilement contrôlables, car on ne bénéficie pas de l'effet de volume des cycles thermochimiques).
La base de comparaison reste de fait l'électrolyse alcaline. En pratique les rendements potentiels du puits (l'eau) à la roue (hydrogène) sont quasi équivalents (et même légèrement à l'avantage de l'électrolyse alcaline, pour laquelle le coût de la séparation oxygène/eau est plus faible) (voir le paragraphe plus bas sur le procédé). Tout se joue donc sur les pertes de procédés à l'échelle industrielle et sur le couple coût/durée de vie des électrolyseurs, ce dernier étant actuellement très à l'avantage de l'électrolyse alcaline. Ceci explique que les recherches sur l'électrolyse haute température, initiées dans les années 1970 n'aient pas encore débouché sur un pilote pré-industriel.
Économie de l'hydrogène (remarque)
Le marché de l'hydrogène est important : 50 millions de tonnes par an en 2004, soit environ 135 milliards de dollars, et en forte croissance, atteignant 94 millions de tonnes en 2021 , dont l'essentiel pour le raffinage (élimination du soufre) et la production d'ammoniac (pour l'industrie des engrais notamment) ; cette production provient pour 62 % du gaz naturel, 18 % du pétrole, 19 % du charbon, 0,7 % d'une énergie fossile avec captage et valorisation du CO2 et 0,04 % de l'électrolyse de l'eau[2].
Si des automobiles à propulsion basées sur l'hydrogène se répandaient, leur consommation augmenterait énormément la demande d'hydrogène (la consommation des carburants routiers se comptant actuellement en milliards de tonnes chaque année[3]).
Sur le procédé
Durant l'électrolyse, la quantité d'énergie électrique à apporter doit être au moins égale à la variation de l'énergie libre de Gibbs de la réaction additionnée des pertes du système. Les pertes peuvent (théoriquement) être arbitrairement proche de zéro, et ainsi le rendement thermodynamique du procédé proche de 100 %.
Dans la majorité des cas, comme dans l'électrolyse de l'eau à température ambiante, l'apport électrique est plus important que la variation d'enthalpie de la réaction, et donc de l'énergie est gaspillée en chaleur perdue. Dans d'autres cas cependant, comme l'électrolyse de la vapeur en hydrogène et oxygène à haute température, on peut espérer théoriquement faire l'inverse. La chaleur serait absorbée depuis l'environnement, et la quantité de chaleur équivalente à l'hydrogène produit est plus importante que l'énergie électrique fournie. Dans ce cas, on pourrait croire que le rendement énergétique est supérieur à 100 %. Cependant il faut considérer le procédé dans sa globalité (de l'eau à 25 °C, 1 bar à l'hydrogène à 25 °C, 1 bar), ce qui amène des dépenses énergétiques complémentaires :
- d'une part, la source de chaleur à haute température doit être comptabilisée au bilan énergétique
- ensuite la montée en température a un coût énergétique : en effet il coûte plus cher de chauffer les réactifs (ici l'eau) que l'énergie récupérable par le refroidissement des fluides sortants (oxygène et hydrogène) ;
- enfin cette réaction est incomplète (d'après la loi de Nernst), sauf à fonctionner avec de fortes surtensions à l'électrolyse. Cela oblige à faire recirculer beaucoup plus d'eau que d'hydrogène produit, ce qui engendre un coût supplémentaire lié à la vaporisation de cette eau introduite (on ne peut pas, conformément à la seconde loi de la thermodynamique, récupérer directement l'énergie de condensation de l'eau qui n'a pas réagi pour vaporiser l'eau en entrée) ;
- enfin il faut comptabiliser au bilan la surtension nécessaire pour faire passer l'oxygène à travers la membrane, sachant qu'il faut impérativement éviter que celui-ci reste avec l'hydrogène créé.
On s'aperçoit alors qu'en pratique, le rendement potentiel d'un procédé d'électrolyse haute température, du puits (l'eau à 25 °C) à la roue (l'hydrogène produit) n'est guère meilleur que le rendement industriel d'une simple électrolyse alcaline.
Un autre problème de ce type de procédé est le coût très élevé des matériaux utilisés et leur durée de vie, actuellement de plusieurs ordres de grandeur inférieure à celle d'électrolyseurs alcalins. Les phénomènes de corrosion sont en effet exacerbés à haute température et les contraintes thermo-mécaniques beaucoup plus importantes pour ce type de procédé.
Réalisations
S'appuyant sur la technologie rSOC d'électrolyse réversible à haute température du CEA, la start-up Sylfen commercialise le Smart Energy Hub, une solution modulaire et hybride pour le stockage d'énergie et la cogénération. L'objectif est d'approvisionner les bâtiments à partir de sources énergétiques locales renouvelables. Le premier exemplaire (100 kW) devait être livré fin 2019 pour un bâtiment du campus de l'innovation Envipark de Turin, alimenté par des panneaux solaires et une microturbine[4].
Un consortium réunissant le CEA, Neste, Paul Wurth, Engie et Sunfire annonce en mars 2020 son projet de construire et exploiter le premier électrolyseur haute température de 2,6 MW, « Multiplhy », produisant de l’hydrogène vert dans la raffinerie de Neste à Rotterdam. Son rendement électrique devrait être supérieur d’au moins 20 % au rendement des électrolyseurs à basse température. D’ici fin 2024, 960 tonnes d’hydrogène vert devraient être produits[5].
Voir aussi
Article connexe
Bibliographie
- Thierry Alleau, chap. 3.2.1 « Production d’hydrogène par électrolyse de l’eau », dans Mémento de l’hydrogène, Association française pour l'hydrogène et les piles à combustible (AFHYPAC), (lire en ligne [PDF]).
Références
- « GuidEnR HQE > Les différentes technologies d’électrolyseurs », sur www.hqe.guidenr.fr (consulté le )
- « Un « élan croissant » pour la production d'hydrogène bas carbone mais... | Connaissances des énergies », sur www.connaissancedesenergies.org, (consulté le )
- (en) « World oil final consumption by sector, 2018 », sur www.iea.org, (consulté le )
- L'électrolyse à haute température du CEA portée par la start-up Sylfen, Les Échos, 26 février 2021.
- Hydrogène : Le premier projet d’électrolyse à haute température de plusieurs MW sera construit à Rotterdam, PV Magazine, 10 mars 2020.
- (en) U.S. Rapport sur la HTE
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « High-temperature electrolysis » (voir la liste des auteurs).