Électrochimiluminescence
L'électrochimiluminescence (abréviation ECL) ou encore chimiluminescence électrogénérée est un phénomène de luminescence qui est initié par une étape de transfert d'électron à la surface d'une électrode.
Historique
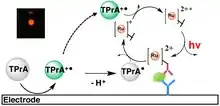
Le phénomène d’ECL a été observé pour la première fois au milieu des années soixante par Hercules[1] et Chandross[2] à partir de solutions d’hydrocarbures aromatiques tels que le 9,10-diphénylanthracène préparées dans des solvants non-aqueux. Le mécanisme impliquait la formation par une étape initiale de réduction et d’oxydation électrochimique de radicaux anions et cations, respectivement. Leur recombinaison ou annihilation chimique régénère la molécule neutre dont une fraction se trouve dans un état excité, lequel peut ensuite relaxer à l’état fondamental en émettant un photon. Depuis ses premiers travaux, l’ECL a connu un développement remarquable, notamment sous l’impulsion du groupe de Bard[3] - [4] - [5] - [6]. La recherche dans le domaine de l’ECL a permis de découvrir et mettre au point un grand nombre de systèmes moléculaires efficaces basés sur un luminophore organique ou inorganique utilisé seul ou bien en combinaison avec un co-réactif sacrificiel. Le système modèle le plus étudié jusqu’à aujourd’hui est le luminophore [Ru(bpy)]32+ utilisé avec la tripropylamine comme co-réactif[7].
Mécanisme
Différents chemins mécanistiques permettent l’émission d’ECL. Même si le mécanisme d’annihilation est le premier qui a été décrit, l’utilisation d’un co-réactif est bien plus utilisée dans la littérature. L’idée centrale est d’oxyder simultanément le luminophore et le co-réactif à la surface de l’électrode. Après une étape de dissociation chimique, le produit d’oxydation du co-réactif est transformé en radical très réducteur qui réagit avec le produit d’oxydation du luminophore pour générer l’état excité. De façon analogue, un mécanisme comparable peut être mis en œuvre par réduction plutôt qu’oxydation. Néanmoins, des études récentes ont montré qu’il existe en réalité de nombreux chemins mécanistiques qui sont en compétition et permettent d’expliquer les résultats expérimentaux, notamment l’extrême sensibilité de cette méthode de mesure[8] - [9] - [10].
Applications
Depuis ces premiers travaux académiques, l’ECL est devenue aujourd’hui une technique analytique très performante pour la détection de biomolécules. En effet, l’ECL présente un certain nombre d’avantages sur d’autres techniques analytiques telles que la photoluminescence, en particulier parce qu’aucune source lumineuse n’est nécessaire pour exciter les sondes, ce qui permet d’obtenir un excellent rapport signal sur bruit. De plus, l’intensité ECL est proportionnelle à la quantité de luminophore et de co-réactif engagée, ce qui permet d’acquérir un signal dépendant de la concentration sur plusieurs ordres de grandeur. Ainsi, l’ECL est très utilisée dans le diagnostic médical, notamment pour détecter la présence d’anticorps spécifiques même sous forme de traces dans des échantillons de sang ou d’urine. Dans ce contexte, plus de 150 immunotests ECL sont actuellement commercialisés pour des pathologies variées allant des maladies cardiaques à la détection de marqueurs tumoraux. Cela représente en tout plus de 1 milliard d’analyses immunologiques réalisées par an grâce à la technologie ECL. Les deux leaders du marché sont Roche Diagnostics Inc. et Meso Scale Discovery Inc.
Notes et références
- Hercules, D. M., Chemiluminescence Resulting from Electrochemically Generated Species, Science 1964, 145, 808.
- Visco, R. E., Chandross, E. A., Electroluminescence in Solutions of Aromatic Hydrocarbons, J. Am. Chem. Soc. 1964, 86, 5350..
- Bard, A. J. Electrogenerated Chemiluminescence; M. Dekker: New-York, 2004.
- Richter, M. M., Electrochemiluminescence (ECL), Chem. Rev. 2004, 104, 3003.
- Miao, W., Electrogenerated Chemiluminescence and Its Biorelated Applications, Chem. Rev. 2008, 108, 2506.
- Liu, Z., Qi, W., Xu, G., Recent advances in electrochemiluminescence, Chem. Soc. Rev. 2015, 44, 3117.
- Leland, J. K., Powell, M. J., Electrogenerated Chemiluminescence: An Oxidative‐Reduction Type ECL Reaction Sequence Using Tripropyl Amine, J. Electrochem. Soc. 1990, 137, 3127.
- Miao, W., Choi, J.-P., Bard, A. J., Electrogenerated Chemiluminescence 69: The Tris(2,2’-bipyridine)ruthenium(II), [Ru(bpy)32+)/Tri-n-propylamine (TPrA) System Revisited A New Route Involving TPrA•+ Cation Radicals, J. Am. Chem. Soc. 2002, 124, 14478.
- Klymenko, O. V., Svir, I., Amatore, C., A New Approach for the Simulation of Electrochemiluminescence (ECL), ChemPhysChem 2013, 14, 2237.
- Sentic, M., Milutinovic, M., Kanoufi, F., Manojlovic, D., Arbault, S., Sojic, N., Mapping electrogenerated chemiluminescence reactivity in space: mechanistic insight into model systems used in immunoassays, Chem. Sci. 2014, 5, 2568.